Un estudio liderado por el Instituto Hospital del Mar de Investigaciones Médicas demuestra que el oxaliplatino que se administra en algunos casos de cáncer de colon y recto se acumula en las células sanas del entorno del tumor.
Este hecho provoca que estas células sanas generen una proteína que las activa, pudiendo así provocar resistencia de las células tumorales al tratamiento y ayudando al hecho que se vuelva a generar el tumor. A la vez, se ha descubierto un marcador que permite identificar los tumores que tienen expresada esta proteína y, por lo tanto, no responden a la quimioterapia.
El estudio, que publica la revista Nature Communications, abre la puerta a nuevos tratamientos que permitan potenciar los efectos de la quimioterapia sobre las células tumorales, evitando los efectos secundarios sobre las células sanas del tumor y, de esta forma, evitar la progresión tumoral.
Uno de los tipos de quimioterapia que sirve para tratar el cáncer de colon y recto avanzado, la quimioterapia basada en el platino, se acumula en las células sanas que rodean las células cancerosas, y, como consecuencia, puede hacer disminuir la sensibilidad del cáncer en el tratamiento. Así lo demuestra un estudio del Instituto Hospital del Mar de Investigaciones Médicas (IMIM-Hospital del Mar), con participación del Instituto de Investigación Sanitaria INCLIVA, el Institut Català d’Oncologia (ICO), el Vall d’Hebron Instituto de Oncología (VHIO), el Institut de Recerca Biomèdica (IRB) de Barcelona, la Universidad de Oviedo y el CIBER del cáncer (CIBERONC), que publica la revista Nature Communications.
Un número elevado de pacientes en tratamiento por cáncer reciben tratamientos basados en el platino. Pero un buen número de tumores tienen la capacidad de generar resistencia en este abordaje. Para averiguar los motivos, este trabajo ha analizado muestras de pacientes con cáncer de colon y recto avanzado y han validado los resultados en modelos de ratón. Así han podido ver cómo en estos tratamientos, el platino se acumula de forma muy destacada en las células sanas que rodean al tumor, en especial en los fibroblastos, las células que contribuyen a la creación de tejidos. Además, esta acumulación se mantiene durante largos periodos de tiempo, más de dos años después de la finalización del tratamiento. Para hacerlo, se han utilizado técnicas desarrolladas en el campo de la geología aplicadas a las muestras biológicas.
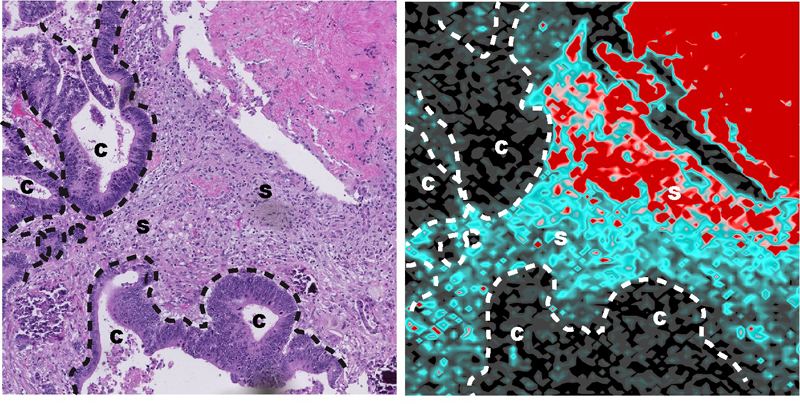 Acumulación de oxaliplatino en el microambiente tumoral de un paciente con cáncer de colon 44 días después del tratamiento.
Acumulación de oxaliplatino en el microambiente tumoral de un paciente con cáncer de colon 44 días después del tratamiento.
El efecto del platino sobre los fibroblastos
Los investigadores pudieron comprobar como esta acumulación de platino en los fibroblastos, generaba la activación de determinados genes, vinculados a una mala respuesta al tratamiento con quimioterapia y a la progresión tumoral, entre ellos, los relacionados con la proteína TGF-β, que estimula a los mismos fibroblastos y provoca que ayuden a las células tumorales que han sobrevivido a la quimioterapia a progresar de nuevo. Esto lleva al Dr. Alexandre Calon, responsable del Laboratorio de Investigación traslacional en microambiente tumoral del IMIM-Hospital del Mar, y que lidera el estudio, a apuntar que «la activación de los fibroblastos, por el oxaliplatino puede generar mecanismos de resistencia a la misma quimioterapia».
Actualmente, no se dispone de marcadores predictivos de respuesta a la quimioterapia en cáncer de colon y recto. En este sentido, este trabajo ha permitido comprobar con muestras de una treintena de pacientes, de antes y de después de someterse a quimioterapia, que los niveles de otra proteína, la periostina, son un indicador de actividad de TGF-β en los fibroblastos, y funcionan como un buen marcador de respuesta a la quimioterapia. Así, esta respuesta era mala en aquellas personas en les cuales los niveles de periostina eran elevados antes de recibir las primeras dosis o en aquellos que eran bajos, pero se disparaban después del tratamiento. Así mismo, en modelos de ratón se certificó que en aquellos los cuales se provocaban niveles más altos de esta proteína, el tratamiento contra el tumor pierde efectividad.
Por todo ello, la Dra. Jenniffer Linares, primera autora del estudio, afirma que «hemos descubierto un mecanismo de resistencia al oxaliplatino y un marcador de esta resistencia en pacientes con cáncer de colon y recto». Un hecho que demuestra, según el Dr. Calon, que hay que tener en cuenta el entorno del tumor a la hora de desarrollar los tratamientos contra el cáncer. «Las quimioterapias se evalúan en relación con su efectividad sobre las células cancerosas, no sobre las células sanas que forman el microambiente tumoral, que protege al tumor», apunta.
Buscar una forma de superarlo
Los investigadores trabajan ahora para desarrollar un nuevo tipo de abordaje que permita restaurar la capacidad de la quimioterapia sobre las células tumorales. Lo han hecho en un nuevo estudio pendiente de publicación, y se basa en la combinación de la medicación con un péptido que evita que el platino se acumule en los fibroblastos.
En este sentido, el Dr. Andrés Cervantes, director científico del Instituto de Investigación Biomédica INCLIVA e investigador del CIBER del Cáncer (CIBERONC), apunta que «el estudio refuerza el protagonismo que las células no tumorales pueden tener en la respuesta a la quimioterapia y que estos descubrimientos abren la puerta a una estrategia de oncología de precisión que permita reconocer la diversidad de los mecanismos de sensibilidad y resistencia a los tratamientos, actuando de manera diferente según los mismos y facilitando una acción más personalizada».
Tal como dice la Dra. Clara Montagut, jefa de sección de tumores gastrointestinales del Hospital del Mar e investigadora del CIBERONC, «este estudio es un paso importante para entender por qué el tratamiento de quimioterapia no funciona igual en todos los pacientes con cáncer, y poder prevenir o revertir la resistencia a la quimioterapia. Es un paso relevante también para comprender que el tratamiento del cáncer tiene que tener en cuenta no solo las células cancerosas, sino también a las células sanas que envuelven al tumor, el llamado microambiente. El siguiente paso crítico será desarrollar estrategias farmacológicas que actúen sobre la célula cancerosa y modulen el microambiente a favor de la eliminación del tumor».
El trabajo ha contado con el apoyo del Instituto de Salud Carlos III y de la Asociación Española Contra el Cáncer (TuMICC project, Junior Clinician fellowship).
La participación del VHIO en este estudio ha sido en el marco del proyecto TUMICC dirigido a demostrar el valor del microambiente tumoral en la predicción de recaídas en pacientes con cáncer de colon localizado tratados con tratamiento adyuvante. Los grupos de VHIO que forman parte son el Grupo de Células Madre y Cáncer liderado por el Dr. Hector García Palmer, el Grupo de Investigación en Cáncer colorrectal liderado por la Dra. Elena Élez y el Grupo de Oncología Molecular, liderado por el Dr. Paolo Nuciforo. En este estudio que ahora publica Nature Medicine, VHIO ha participado en la inclusión de pacientes en el estudio así como en la recogida de muestras e imágenes del tumor tanto prospectiva como retrospectivamente. El VHIO ha liderado la generación de los modelos preclínicos de pacientes, más específicamente los modelos xenógrafos derivados de pacientes.
Artículo de referencia
Linares, J., Sallent-Aragay, A., Badia-Ramentol, J. et al. Long-term platinum-based drug accumulation in cancer-associated fibroblasts promotes colorectal cancer progression and resistance to therapy. Nat Commun 14, 746 (2023). https://doi.org/10.1038/s41467-023-36334-1