
Nuestro grupo lleva a cabo investigaciones preclínicas del cáncer de mama para avanzar en el conocimiento de los biomarcadores de respuesta a las terapias dirigidas. Para ello, generamos modelos preclínicos como los xenoinjertos derivados del paciente (PDX) y los cultivos derivados del paciente (PDC) a partir de muestras de pacientes con cáncer de mama.
Hemos contribuido significativamente al campo de la resistencia endocrina y seguimos ahondando en los mecanismos de resistencia a los inhibidores de CDK4/6, los inhibidores de FGFR, los inhibidores de AKT y los moduladores de AR (SARM) en los tumores de mama. Mediante el uso de PDX clínicamente relevantes, hemos proporcionado datos que respaldan en mayor medida que la pérdida de control del punto de control del ciclo celular G1, como la mutación/pérdida de RB1 o la amplificación de CCND1, está asociada con la falta de respuesta al bloqueo de CDK4/6 en el cáncer de mama con receptores de estrógeno positivos. Además, hemos generado una colección de PDX que contienen amplificación de FGFR para estudiar biomarcadores de sensibilidad a los inhibidores de FGFR, tanto pan-FGFR1-4 como inhibidores multiobjetivo de la tirosina quinasa (MTKI).
Asimismo, estamos explorando el potencial de un nuevo conjugado anticuerpo-fármaco (ADC) como estrategia terapéutica para los cánceres de mama avanzados que han desarrollado resistencia a los tratamientos de referencia actuales.
Animados por el éxito temprano de los inhibidores de reparación del daño del ADN en tumores mutados BRCA1/2 de la línea germinal, iniciamos un proyecto destinado a identificar los biomarcadores de respuesta de los inhibidores de PARP (iPARP), así como otros inhibidores de reparación del daño del ADN, incluidos los dirigidos a WEE1 o ATR.
Nuestros estudios respaldan la capacidad de los tumores mutantes BRCA1/2 de la línea germinal para recuperar la funcionalidad reparadora del ADN y desarrollar resistencia a los iPARP. Hemos desarrollado un ensayo, la prueba RAD51, que identifica con precisión los tumores BRCA1/2 de la línea germinal que han recuperado la funcionalidad reparadora del ADN y se vuelven resistentes a estos fármacos. Es importante destacar que esta prueba también identifica los tumores sensibles a iPARP por las alteraciones de la reparación del ADN mediante recombinación homóloga más allá de la enfermedad BRCA1/2 de la línea germinal. Presentamos una patente (solicitud para la UE en 2017 y PCT en 2018) y actualmente estamos validando el uso de esta prueba en muestras tumorales de pacientes con cáncer de mama, ovario, páncreas y próstata.
Por último, también estamos investigando los efectos de los iPARP en el entorno inmunitario del tumor. Los tumores con deficiencia en la reparación del ADN acumulan ADN citosólico, que puede provocar una señal inmunitaria innata (la vía STING) y aumentar los genes relacionados con el interferón, lo que da lugar a la infiltración linfocítica y la expresión de PD-L1. Estamos probando la hipótesis de que el tratamiento de tumores con deficiencia en la reparación del ADN con iPARP provoca una respuesta de daño en el ADN, lo que resulta en el aumento de PD-L1 que podría limitar la citotoxicidad antitumoral inmunomediada por linfocitos, pero sensibiliza ante los tratamientos anti-PD-L1.
Nuestro grupo colabora estrechamente con el Grupo de Cáncer de Mama de Cristina Saura y el Grupo de Genética del Cáncer Hereditario de Judith Balmaña. Como reflejo del enfoque puramente multidisciplinar y traslacional del VHIO, nuestra investigación también se lleva a cabo en colaboración con otros grupos, tales como los Grupos de Oncología Molecular, Genómica del Cáncer y Oncology Data Science (Grupo ODysSey) del VHIO, dirigidos por Paolo Nuciforo, Ana Vivancos y Rodrigo Dienstmann, respectivamente.
En resumen, nuestro equipo ha avanzado significativamente en la comprensión del modo de acción de los nuevos tratamientos dirigidos, ha identificado nuevos biomarcadores de respuesta y ha desarrollado un ensayo basado en biomarcadores con posible aplicación clínica. También hemos demostrado la eficacia de las combinaciones de fármacos basadas en hipótesis.
- Desarrollo de biomarcadores predictivos de tratamientos dirigidos en cánceres de mama ER+ y triple negativo, incluidos los inhibidores dirigidos contra la proteína PARP de reparación del daño del ADN y contra las quinasas de señalización / ciclo celular (CDK4/6, PI3K/AKT o FGFR).
- Explorar nuevas combinaciones de tratamientos para los cánceres de mama ER+ y triple negativo.
- Contribución a la medicina personalizada mediante el desarrollo de una prueba diagnóstica para orientar mejor las estrategias de tratamiento basadas en inhibidores de PARP.
- Establecimiento de modelos preclínicos de cáncer de mama derivados de tumores de pacientes para explorar terapias combinatorias basadas en hipótesis.
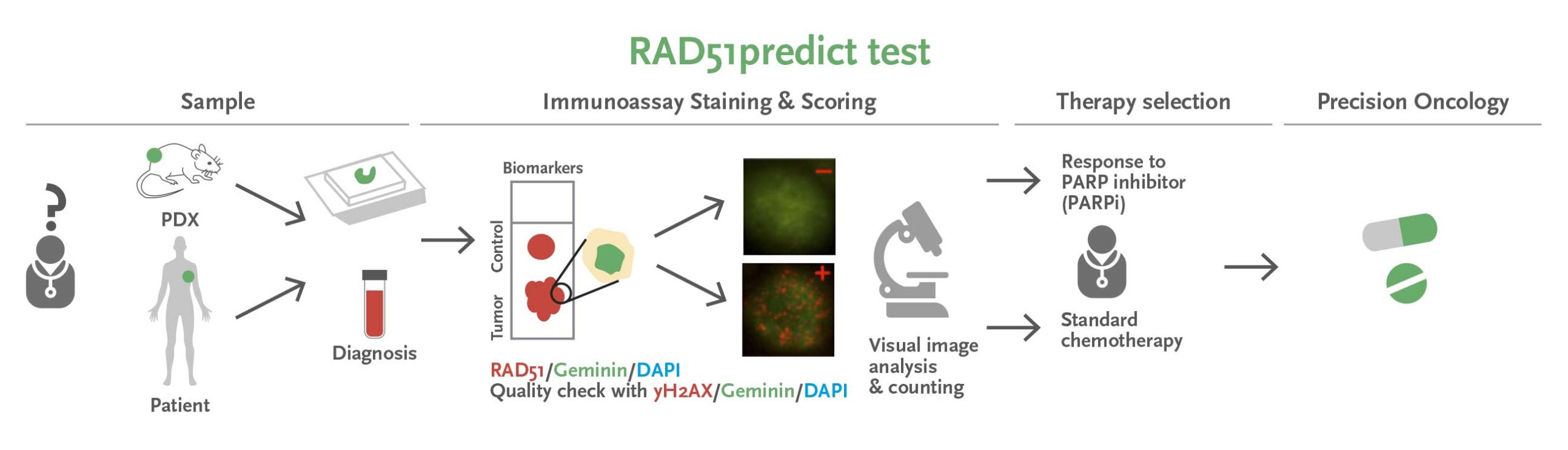
Figure: RAD51predict (predictor of PARPi response) is an immunofluorescence assay, performed on FFPE tumor sections, that identifies nuclear biomarkers and determines the functionality of the HRR DNA-damage pathway and the response to PARPi therapy. It has been validated in PDX models and we are currently extending the clinical validation to several tumor types.
Jefa de grupo
Violeta Serra
Becarios postdoctorales
Alba Llop-Guevara
Estudiantes de postgrado
Laia Monserrat
Flaminia Pedretti
Andrea Herencia
Heura Domènech
Andreu Òdena
Estudiantes visitantes
Giorgia Casali
Técnicas
Olga Rodríguez
Marta Guzmán
Publicaciones científicas más relevantes
- Palafox M, Monserrat L, Bellet M, Villacampa G, Gonzalez-Perez A, Oliveira M, Brasó-Maristany F, Ibrahimi N, Kannan S, Mina L, Herrera-Abreu MT, Òdena A, Sánchez-Guixé M, Capelán M, Azaro A, Bruna A, Rodríguez O, Guzmán M, Grueso J, Viaplana C, Hernández J, Su F, Lin K, Clarke RB, Caldas C, Arribas J, Michiels S, García-Sanz A, Turner NC, Prat A, Nuciforo P, Dienstmann R, Verma CS, Lopez-Bigas N, Scaltriti M, Arnedos M, Saura C, Serra V. High p16 expression and heterozygous RB1 loss are biomarkers for CDK4/6 inhibitor resistance in ER+ breast cancer. Nat Commun. 2022 Sep 7;13(1):5258.
- Serra V, Wang AT, Castroviejo-Bermejo M, Polanska UM, Palafox M, Herencia-Ropero A, Jones GN, Lai Z, Armenia J, Michopoulos F, Llop-Guevara A, Brough R, Gulati A, Pettitt SJ, Bulusu KC, Nikkilä J, Wilson Z, Hughes A, Wijnhoven PWG, Ahmed A, Bruna A, Gris-Oliver A, Guzman M, Rodríguez O, Grueso J, Arribas J, Cortés J, Saura C, Lau A, Critchlow S, Dougherty B, Caldas C, Mills GB, Barrett JC, Forment JV, Cadogan E, Lord CJ, Cruz C, Balmaña J, O’Connor MJ. Identification of a Molecularly-Defined Subset of Breast and Ovarian Cancer Models that Respond to WEE1 or ATR Inhibition, Overcoming PARP Inhibitor Resistance. Clin Cancer Res. 2022 Oct 14;28(20):4536-4550.
- Pellegrino B, Herencia-Ropero A, Llop-Guevara A, Pedretti F, Moles-Fernández A, Viaplana C, Villacampa G, Guzmán M, Rodríguez O, Grueso J, Jiménez J, Arenas EJ, Degasperi A, Dias JML, Forment JV, O’Connor MJ, Déas O, Cairo S, Zhou Y, Musolino A, Caldas C, Nik-Zainal S, Clarke RB, Nuciforo P, Díez O, Serres-Créixams X, Peg V, Espinosa-Bravo M, Macarulla T, Oaknin A, Mateo J, Arribas J, Dienstmann R, Bellet M, Oliveira M, Saura C, Gutiérrez-Enríquez S, Balmaña J, Serra V. Preclinical In Vivo Validation of the RAD51 Test for Identification of Homologous Recombination-Deficient Tumors and Patient Stratification. Cancer Res. 2022 Apr 15;82(8):1646-1657.
- Sánchez-Guixé M, Hierro C, Jiménez J, Viaplana C, Villacampa G, Monelli E, Brasó-Maristany F, Ogbah Z, Parés M, Guzmán M, Grueso J, Rodríguez O, Oliveira M, Azaro A, Garralda E, Tabernero J, Casanovas O, Scaltriti M, Prat A, Dienstmann R, Nuciforo P, Saura C, Graupera M, Vivancos A, Rodon J, Serra V. High FGFR1-4 mRNA Expression Levels Correlate with Response to Selective FGFR Inhibitors in Breast Cancer. Clin Cancer Res. 2022 Jan 1;28(1):137-149.
- Sánchez-Guixé M, Hierro C, Jiménez J, Viaplana C, Villacampa G, Monelli E, Brasó-Maristany F, Ogbah Z, Parés M, Guzmán M, Grueso J, Rodríguez O, Oliveira M, Azaro A, Garralda E, Tabernero J, Casanovas O, Scaltriti M, Prat A, Dienstmann R, Nuciforo P, Saura C, Graupera M, Vivancos A, Rodon J, Serra V. High FGFR1-4 mRNA Expression Levels Correlate with Response to Selective FGFR Inhibitors in Breast Cancer. Clin Cancer Res. 2022 Jan 1;28(1):137-149. Epub 2021 Sep 30.
- Llop-Guevara A, Loibl S, Villacampa G, Vladimirova V, Schneeweiss A, Karn T, Zahm DM, Herencia-Ropero A, Jank P, van Mackelenbergh M, Fasching PA, Marmé F, Stickeler E, Schem C, Dienstmann R, Florian S, Nekljudova V, Balmaña J, Hahnen E, Denkert C, Serra V. Association of RAD51 with homologous recombination deficiency (HRD) and clinical outcomes in untreated triple-negative breast cancer (TNBC): analysis of the GeparSixto randomized clinical trial. Ann Oncol. 2021 Dec;32(12):1590-1596.
- Carreira S, Porta N, Arce-Gallego S, Seed G, Llop-Guevara A, Bianchini D, Rescigno P, Paschalis A, Bertan C, Baker C, Goodall J, Miranda S, Riisnaes R, Figueiredo I, Ferreira A, Pereira R, Crespo M, Gurel B, Nava Rodrigues D, Pettitt SJ, Yuan W, Serra V, Rekowski J, Lord CJ, Hall E, Mateo J, de Bono JS. Biomarkers Associating with PARP Inhibitor Benefit in Prostate Cancer in the TOPARP-B Trial. Cancer Discov. 2021 Nov;11(11):2812-2827.
- Gris-Oliver A, Ibrahim YH, Rivas MA, García-García C, Sánchez-Guixé M, Ruiz-Pace F, Viaplana C, Pérez-García JM, Llombart-Cussac A, Grueso J, Parés M, Guzmán M, Rodríguez O, Anton P, Cozar P, Calvo MT, Bruna A, Arribas J, Caldas C, Dienstmann R, Nuciforo P, Oliveira M, Cortés J, Serra V. PI3K activation promotes resistance to eribulin in HER2-negative breast cancer. Br J Cancer. 2021 Apr;124(9):1581-1591.
- Pellegrino B, Mateo J, Serra V, Balmaña J. Controversies in oncology: are genomic tests quantifying homologous recombination repair deficiency (HRD) useful for treatment decision making? ESMO Open. 2019 May 9;4(2):e000480.
- Mateo J, Lord CJ, Serra V, Tutt A, Balmaña J, Castroviejo-Bermejo M, Cruz C, Oaknin A, Kaye SB, de Bono JS. A decade of clinical development of PARP inhibitors in perspective. Ann. Oncol. 2019 Sep 1;30(9):1437-1447.
- Gourley C, Balmaña J, Ledermann JA, Serra V, Dent R, Loibl S, Pujade-Lauraine E, Boulton SJ. Moving From Poly (ADP-Ribose) Polymerase Inhibition to Targeting DNA Repair and DNA Damage Response in Cancer Therapy. J. Clin. Oncol. 2019 Sep 1;37(25):2257-2269.
- Green JL, Okerberg ES, Sejd J, Palafox M, Monserrat L, Alemayehu S, Wu J, Sykes M, Aban A, Serra V, Nomanbhoy T. Direct CDKN2 Modulation of CDK4 Alters Target Engagement of CDK4 Inhibitor Drugs. Mol. Cancer Ther. 2019 Apr;18(4):771-779.
- Cruz C, Castroviejo-Bermejo M, Gutiérrez-Enríquez S, Llop-Guevara A, Ibrahim YH, Gris-Oliver A, Bonache S, Morancho B, Bruna A, Rueda OM, Lai Z, Polanska UM, Jones GN, Kristel P, de Bustos L, Guzman M, Rodríguez O, Grueso J, Montalban G, Caratú G, Mancuso F, Fasani R, Jiménez J, Howat WJ, Dougherty B, Vivancos A, Nuciforo P, Serres-Créixams X, Rubio IT, Oaknin A, Cadogan E, Barrett JC, Caldas C, Baselga J, Saura C, Cortés J, Arribas J, Jonkers J, Díez O, O’Connor MJ, Balmaña J, and Serra V. RAD51 foci as a functional biomarker of homologous recombination repair and PARP inhibitor resistance in germline BRCA-mutated breast cancer. Ann Oncol. 2018 May 1;29(5):1203-1210.
- Castroviejo-Bermejo M, Cruz C, Llop-Guevara A, Gutiérrez-Enríquez S, Ducy M, Ibrahim YH, Gris-Oliver A, Pellegrino B, Bruna A, Guzmán M, Rodríguez O, Grueso J, Bonache S, Moles-Fernández A, Villacampa G, Viaplana C, Gómez P, Vidal M, Peg V, Serres-Créixams X, Dellaire G, Simard J, Nuciforo P, Rubio IT, Dientsmann R, Barrett JC, Caldas C, Baselga J, Saura C, Cortés J, Déas O, Jonkers J, Masson JY, Cairo S, Judde JG, O’Connor MJ, Díez O, Balmaña J, and Serra V. A RAD51 assay feasible in routine tumor samples calls PARP inhibitor response beyond BRCA mutation. EMBO Mol Med. 2018 Dec;10(12).
- Cruz C, Llop-Guevara A, Garber JE, Arun BK, Pérez Fidalgo JA, Lluch A, Telli ML, Fernández C, Kahatt C, Galmarini CM, Soto-Matos A, Alfaro V, Pérez de la Haza A, Domchek SM, Antolin S, Vahdat L, Tung NM, Lopez R, Arribas J, Vivancos A, Baselga J, Serra V, Balmaña J, and Isakoff SJ. Multicenter Phase II Study of Lurbinectedin in BRCA-Mutated and Unselected Metastatic Advanced Breast Cancer and Biomarker Assessment Substudy. J Clin Oncol. 2018 Nov 1;36(31):3134-3143.
- Gawrzak S, Rinaldi L, Gregorio S, Arenas EJ, Salvador F, Urosevic J, Figueras-Puig C, Rojo F, Del Barco Barrantes I, Cejalvo JM, Palafox M, Guiu M, Berenguer-Llergo A, Symeonidi A, Bellmunt A, Kalafatovic D, Arnal-Estapé A, Fernández E, Müllauer B, Groeneveld R, Slobodnyuk K, Stephan-Otto Attolini C, Saura C, Arribas J, Cortes J, Rovira A, Muñoz M, Lluch A, Serra V, Albanell J, Prat A, Nebreda AR, Benitah SA, Gomis RR. MSK1 regulates luminal cell differentiation and metastatic dormancy in ER+ breast cancer. Nat Cell Biol. 2018 Feb;20(2):211-221.
- Méndez-Pertuz M, Martínez P, Blanco-Aparicio C, Gómez-Casero E, Belen García A, Martínez-Torrecuadrada J, Palafox M, Cortés J, Serra V, Pastor J, Blasco MA. Modulation of telomere protection by the PI3K/AKT pathway. Nat Commun. 2017 Nov 2;8(1):1278.
- Zabala-Letona A, Arruabarrena-Aristorena A, Martín-Martín N, (…), Serra V, (…), Carracedo A. mTORC1-dependent AMD1 regulation sustains polyamine metabolism in prostate cancer. Nature. 2017 Jul 6;547(7661):109-113.
- Hierro C, Alsina M, Sánchez M, Serra V, Rodon J, Tabernero J. Targeting the fibroblast growth factor receptor 2 in gastric cancer: promise or pitfall? Ann Oncol. 2017 Jun 1;28(6):1207-1216.
- Byrne AT, Alférez DG, Amant F, Annibali D, Arribas J, Biankin AV, Bruna A, Budinská E, Caldas C, Chang DK, Clarke RB, Clevers H, Coukos G, Dangles-Marie V, Eckhardt SG, Gonzalez-Suarez E, Hermans E, Hidalgo M, Jarzabek MA, de Jong S, Jonkers J, Kemper K, Lanfrancone L, Mælandsmo GM, Marangoni E, Marine JC, Medico E, Norum JH, Palmer HG, Peeper DS, Pelicci PG, Piris-Gimenez A, Roman-Roman S, Rueda OM, Seoane J, Serra V, Soucek L, Vanhecke D, Villanueva A, Vinolo E, Bertotti A, Trusolino L. Interrogating open issues in cancer precision medicine with patient-derived xenografts Interrogating open issues in cancer precision medicine with Patient-Derived Xenografts. Nat Rev Cancer. 2017 Apr; 17(4):254-268.
- Bruna A, Rueda OM, Greenwood W, Batra AS, Callari M, Batra RN, Pogrebniak K, Sandoval J, Cassidy JW, Tufegdzic-Vidakovic A, Sammut SJ, Jones L, Provenzano E, Baird R, Eirew P, Hadfield J, Eldridge M, McLaren-Douglas A, Barthorpe A, Lightfoot H, O’Connor MJ, Gray J, Cortes J, Baselga J, Marangoni E, Welm AL, Aparicio S, Serra V, Garnett MJ, Caldas C. A Biobank of Breast Cancer Explants with Preserved Intra-tumor Heterogeneity to Screen Anticancer Compounds. Cell. 2016 Sep 22;167(1):260-274.e22.
- Brasó-Maristany F, Filosto S, Catchpole S, Marlow R, Quist J, Francesch-Domenech E, Plumb DA, Zakka L, Gazinska P, Liccardi G, Meier P, Gris-Oliver A, Cheang MCU, Perdrix-Rosell A, Shafat M, Noël E, Patel N, McEachern K, Scaltriti M, Castel P, Noor F, Buus R, Mathew S, Watkins J, Serra V, Marra P, Grigoriadis A & Tutt AN. PIM1 kinase regulates cell death, tumor growth and chemotherapy response in triple-negative breast cancer. Nat Med. 2016 Nov;22(11):1303-1313.
- Drost R, Dhillon KK, van der Gulden H, van der Heijden I, Brandsma I, Cruz C, Chondronasiou D, Castroviejo-Bermejo M, Boon U, Schut E, van der Burg E, Wientjens E, Pieterse M, Klijn C, Klarenbeek S, Loayza-Puch F, Elkon R, van Deemter L, Rottenberg S, van de Ven M, Dekkers DH, Demmers JA, van Gent DC, Agami R, Balmaña J, Serra V, Taniguchi T, Bouwman P, Jonkers J. BRCA1185delAG tumors may acquire therapy resistance through expression of RING-less BRCA1. J Clin Invest. 2016 Aug 1;126(8):2903-18.
- Early adaptation and acquired resistance to CDK4/6 inhibition in estrogen receptor positive breast cancer.Herrera-Abreu M*, Palafox M*, Asghar U, Rivas MA, Cutts RJ, Garcia-Murillas I, Pearson A, Guzman M, Rodriguez O, Grueso J, Bellet M, Cortés J, Elliott R, Pancholi S, Baselga J, Dowsett M, Martin LA, Turner NC*, Serra V*. Cancer Research. 2016 Apr 1;76(8):2301-13. IF: 9.329
- The BRCA1-Δ11q Alternative Splice Isoform Bypasses Germline Mutations and Promotes Therapy Resistance. Wang Y, Bernhardy AB, Cruz C, Krais JJ, Nacson J, Nicolas E, Peri S, van der Gulden H, van der Heiiden I, O’Brien SW, Zhang Y, Harrell MI, Johnson SF, Candido Dos Reis FJ, Pharoah PDP, Karlan B, Gourley C, Lambrechts D, Chenevix-Trench G, Olsson H, Benitez JJ, Greene MH, Gore M, Nussbaum R, Sadetzki S, Gayther SA, Kjaer SK, kConFab Investigators, D’Andrea AD, Shapiro GI, Wiest DL, Connolly DC, Daly MB, Swisher EM, Bouwman P, Jonkers J, Balmaña J, Serra V and Johnson N. Cancer Research. 2016, May 1;76(9):2778-90. IF: 9.329/ D=1. Citations#=0
- MEK plus PI3K/mTORC1/2 therapeutic efficacy is impacted by TP53 mutation in preclinical models of colorectal cancer. García-García C, Rivas MA, Ibrahim YH, Calvo MT, Gris-Oliver A, Rodriguez O, Grueso J, Anton P, Guzman M, Aura C, Nuciforo P, Jessen K, Argiles G, Dienstmann R, Bertotti A, Trusolino L, Matito J, Vivancos A, Chicote I, Palmer HG, Tabernero J, Scaltriti M, Baselga J*, Serra V*. Clin Cancer Res. 2015 Dec 15;21(24):5499-510. IF: 8.722/ D=1. Citations#=1
- PI3K inhibition results in enhanced estrogen receptor function and dependence in hormone receptor-positive breast cancer. Bosch A, Li Z, Bergamaschi A, Ellis H, Toska E, Prat A, Tao JJ, Spratt DE, Viola-Villegas NT, Castel P, Minuesa G, Morse N, Rodón J, Ibrahim Y, Cortes J, Perez-Garcia J, Galvan P, Grueso J, Guzman M, Katzenellenbogen JA, Kharas M, Lewis JS, Dickler M, Serra V, Rosen N, Chandarlapaty S, Scaltriti M, Baselga J. Sci Transl Med. 2015 Apr 15;7(283):283ra51. IF: 14.414 / D=1. Citations#=26
- Targeting a cell state common to triple-negative breast cancers. Muellner MK, Mair B, Ibrahim Y, Kerzendorfer C, Lechtermann H, Trefzer C, Klepsch F, Müller AC, Leitner E, Macho-Maschler S, Superti-Furga G, Bennett KL, Baselga J, Rix U, Kubicek S, Colinge J, Serra V, Nijman SM. Mol Syst Biol. 2015 Feb 19;11:789. IF: 14.099 / D=1. Citations#=4
- High HER2 expression correlates with response to the combination of lapatinib and trastuzumab. Scaltriti M, Nuciforo P, Bradbury I, Sperinde J, Agbor-Tarh D, Campbell C, Chenna A, Winslow J, Serra V, Parra JL, Prudkin L, Jimenez J, Aura C, Harbeck N, Pusztai L, Ellis CE, Eidtmann H, Arribas J, Cortes J, De Azambuja E, Piccart M, Baselga J. Clin Cancer Res. 2014 Dec 2. pii:clincanres.1824. IF: 8.193 / D=1. Citations#=17
- Effect of p95HER2/611CTF on the response to trastuzumab and chemotherapy. Parra-Palau JL, Morancho B, PegV, Escorihuela M, Scaltriti M, Vicario R, Zacarias-Fluck M, Pedersen K, Pandiella, A, Nuciforo P, Serra V, Cortes J, Baselga J, Perou CM, Prat A, Rubio IT, Arribas J. JNCI, 2014: 106(11) pii: dju291. IF: 15.161 / D=1. Citations#=12
- Picking the point of inhibition: a comparative review of PI3K/AKT/mTOR pathway inhibitors. Dienstmann R, Rodon J, Serra V, Tabernero J. Mol Cancer Ther. 2014: 13(5), 1021-31. IF: 6.107 / Q=1. Citations#=82
- Evaluation and Clinical Analyses of Downstream Targets of the Akt Inhibitor GDC-0068. *Serra V, *Yan Y, Prudkin L, Scaltriti M, Murli S, Rodríguez O, Guzman M, Sampath D, Nannini M, Xiao Y, Wagle MC, Wu JQ, Wongchenko M, Hampton G, Ramakrishnan V, Lackner MR, Saura C, Roda D, Cervantes A, Tabernero J, Patel P, Baselga J. Clin Cancer Res. 2013: 19(24), 6976-86. IF: 8.193 / D=1. Citations#=19
- Clinical response to lapatinib therapy of a Li-Fraumeni Syndrome patient with a novel HER2-V659E mutation. Serra V, Vivancos A, Puente XS, Felip E, Silberschmidt D, Caratù G, Parra JL, De Mattos-Arruda L, Grueso J, Hernandez-Losa J, Arribas J, Prudkin L, Nuciforo PG, Scaltriti M, Seoane J, Baselga J. Cancer Discovery. 2013: 3(11), 1238-44. IF: 15.929 / D=1. Citations#=10
- mTORC1 inhibition is required for sensitivity to PI3K p110-α inhibitors in PIK3CA-mutant breast cancer. Elkabets M, Vora S, Juric D, Morse N, Mino-Kenudson N, Muranen T, Tao J, Bosch Campos A, Rodon J, Ibrahim YH, Serra V, Rodrik-Outmezguine V, Quadt C, Huang A, Brugge J, Rosen N, Engelman JA, Scaltriti M, Baselga J. Science Translational Medicine. 2013: 5(196): 196ra99. IF: 14.414 / D=1. Citations#=80
- RSK3/4 mediate resistance to PI3K pathway inhibitors in breast cancer. *Serra V, *Eichhorn PJA, García-García C, Ibrahim YH, Prudkin L, Sánchez G, Rodríguez O, Antón P, Parra JLL, Marlow S, Scaltriti M, Pérez-Garcia J, Prat A, Arribas J, Hahn WC, Kim SY, Baselga J. J Clin Invest. 2013: 123(6), 2551-63. IF: 13.765 / D=1. Citations#=35
- Development of PI3K inhibitors: lessons learned from early clinical trials. Rodon J, Dienstmann R, Serra V, Tabernero J. Nat Rev Clin Oncol. 2013: 10(3), 143-53. IF: 15.696 / D=1. Citations#=289
- PI3K inhibition impairs BRCA1/2 expression and sensitizes BRCA proficiente triple negative breast cancer to PARP inhibition. Ibrahim Y H, García-García C, Serra V, He L, Torres-Lockhart K, Prat A, Anton P, Cózar P, Guzmán M, Grueso J, Rodríguez O, Calvo M T, Aura C, Diez O, Rubio I, Pérez J, Rodón J, Cortés J, Ellisen LW, Scaltriti M, Baselga J. Cancer Discovery. 2012: 2(11), 1036-47. IF: 15.929 / D=1. Citations#=167
- Dual mTORC1/2 and HER2 Blockade Results in Antitumor Activity in Preclinical Models of Breast Cancer Resistant to Anti-HER2 Therapy. *García-García C, *Ibrahim YH, Serra V, Calvo MT, Guzmán M, Grueso J, Aura C, Pérez J, Jessen K, Liu Y, Rommel C, Tabernero J, Baselga J, Scaltriti M. Clin Cancer Res. 2012: 1:18(9), 2603-12. IF: 8.193 / D=1. Citations#=86
- Anti-tumor activity of IPI-504, an Hsp90 inhibitor, in HER2 positive trastuzumab-resistant breast cancer. *Serra V, *Scaltriti M, Normant E, Guzman M, Rodriguez O, Lim AR, Slocum KL, West KA, Rodriguez V, Prudkin L, Jimenez J, Aura C and Baselga J. Molecular Cancer Ther. 2011: 10(5), 817-24. IF: 6.107 / Q=1. Citations#=33
- Cyclin E amplification/overexpression, a novel mechanism of trastuzumab resistance in HER2 positive breast cancer patients. *Scaltriti M, *Eichhorn P, Cortés J, Prudkin L, Aura CM, Jiménez J, Chandarlapaty S, Serra V, Prat A, Ibrahim YH, Guzmán M, Gili M, Rodríguez O, Rodríguez S, Pérez J, Green SR, Mai S, Rosen N, Hudis C and Baselga J. PNAS. 2011: 108(9), 3761-6. IF: 9.809 / D=1. Citations#=140
- PI3K inhibition results in enhanced HER signaling and acquired ERK dependency in HER2 overexpressing breast cancer. Serra V, Scaltriti M, Prudkin L, Eichhorn P, Ibrahim YH, Chandarlapaty S, Markman B, Rodriguez O, Guzman M, Rodriguez S, Gili M, Russillo M, Parra JL, Singh S, Arribas J, Rosen N, and Baselga J. Oncogene. 2011: 30(22), 2547-57. IF: 8.559 / D=1. Citations#=275
- AKT Inhibition Relieves Feedback Suppression of Receptor Tyrosine Kinase Expression and Activity. Chandarlapaty S, Sawai A, Scaltriti M, Rodrik-Outmezguine V, Grbovic-Huezo O, Serra V, Majumder PK, Baselga J, Rosen N. Cancer Cell. 2011: 19(1), 58-71. IF: 23.893 / D=1. Citations#=511
- Phosphatidylinositol 3-kinase hyperactivation results in lapatinib resistance that is reversed by the mTOR/phosphatidylinositol 3-kinase inhibitor NVP-BEZ235. Eichhorn PJ, Gili M, Scaltriti M, Serra V, Guzman M, Nijkamp W, Beijersbergen RL, Valero V, Seoane J, Bernards R, Baselga J. Cancer Research. 2008: 68(22), 9221-30. IF: 9.284 / D=1. Citations#=375
- NVP-BEZ235, a dual PI3K/mTOR inhibitor, prevents PI3K signaling and inhibits the growth of cancer cells with activating PI3K mutations. Serra V, Markman B, Scaltriti M, Eichhorn PJ, Valero V, Guzman M, Botero ML, Llonch E, Atzori F, Di Cosimo S, Maira M, Garcia-Echeverria C, Parra JL, Arribas J, Baselga J. Cancer Research. 2008: 68(19), 8022-30. IF: 9.284 / D=1. Citations#=589
Todas las publicaciones
- Analysis of matched primary and recurrent BRCA1/2 mutation-associated tumors identifies recurrence- specific drivers. Shah JB, Pueschl D, Wubbenhorst B, Fan M, Pluta J, D’Andrea K, Hubert AP, Shilan JS, Zhou W, Kraya AA, Llop Guevara A, Ruan C, Serra V, Balmaña J, Feldman M, Morin PJ, Nayak A, Maxwell KN, Domchek SM, Nathanson KL. Nat Commun. 2022 Nov 7;13(1):6728. doi: 10.1038/s41467-022-34523-y. PMID: 36344544.
- Alternative academic approaches for testing homologous recombination deficiency in ovarian cancer in the MITO16A/MaNGO-OV2 trial. Capoluongo ED, Pellegrino B, Arenare L, Califano D, Scambia G, Beltrame L, Serra V, Scaglione GL, Spina A, Cecere SC, De Cecio R, Normanno N, Colombo N, Lorusso D, Russo D, Nardelli C, D’Incalci M, Llop-Guevara A, Pisano C, Baldassarre G, Mezzanzanica D, Artioli G, Setaro M, Tasca G, Roma C, Campanini N, Cinieri S, Sergi A, Musolino A, Perrone F, Chiodini P, Marchini S, Pignata S. ESMO Open. 2022 Oct;7(5):100585. doi: 10.1016/j.esmoop.2022.100585. Epub 2022 Sep 23. PMID: 36156447.
- AKT-mTORC1 reactivation is the dominant resistance driver for PI3Kβ/AKT inhibitors in PTEN-null breast cancer and can be overcome by combining with Mcl-1 inhibitors. Dunn S, Eberlein C, Yu J, Gris-Oliver A, Ong SH, Yelland U, Cureton N, Staniszewska A, McEwen R, Fox M, Pilling J, Hopcroft P, Coker EA, Jaaks P, Garnett MJ, Isherwood B, Serra V, Davies BR, Barry ST, Lynch JT, Yusa K. Oncogene. 2022 Oct 14. doi: 10.1038/s41388-022-02482-9. PMID:36241868.
- High p16 expression and heterozygous RB1 loss are biomarkers for CDK4/6 inhibitor resistance in ER+ breast cancer. Palafox M, Monserrat L, Bellet M, Villacampa G, Gonzalez-Perez A, Oliveira M, Brasó-Maristany F, Ibrahimi N, Kannan S, Mina L, Herrera-Abreu MT, Òdena A, Sánchez-Guixé M, Capelán M, Azaro A, Bruna A, Rodríguez O, Guzmán M, Grueso J, Viaplana C, Hernández J, Su F, Lin K, Clarke RB17, Caldas C, Arribas J, Michiels S, García-Sanz A, Turner NC, Prat A, Nuciforo P, Dienstmann R, Verma C, Lopez-Bigas N, Scaltriti M, Arnedos M, Saura C, Serra V*. Nature Commun. 2022 Sep 7;13(1):5258. doi: 10.1038/s41467-022-32828-6. PMID: 36071033. IF: 14.919.
- Identification of a molecularly-defined subset of breast and ovarian cancer models that respond to WEE1 or ATR inhibition, overcoming PARP inhibitor resistance. Serra V*, Wang AT, Castroviejo-Bermejo M, Polanska UM, Palafox M, Herencia- Ropero A, Jones GN, Lai Z, Armenia J, Michopoulos F, Llop-Guevara A, Brough R, Gulati A, Pettitt SJ, Bulusu KC, Nikkilä J, Wilson Z, Hughes AM, Wijnhoven PWG, Ahmed A, Bruna A, Gris-Oliver A, Guzman M, Rodriguez O, Grueso J, Arribas J, Cortés J, Saura C, Lau A, Critchlow SE, Dougherty B, Caldas C, Mills GB, Barrett JC, Forment JV, Cadogan EB, Lord CJ, Cruz C, Balmaña J, O’Connor MJ. Clin Cancer Res. 2022 Aug 3:CCR-22-0568. doi: 10.1158/1078-0432.CCR-22-0568. Epub ahead of print. PMID: 35921524. IF: 12.531.
- GDF15 Is an Eribulin Response Biomarker also Required for Survival of DTP Breast Cancer Cells. Bellio C, Emperador M, Castellano P, Gris-Oliver A, Canals F, Sánchez-Pla A, Zamora E, Arribas J, Saura C, Serra V, Tabernero J, Littlefield BA, Villanueva J. Cancers (Basel). 2022 May 23;14(10):2562. doi:10.3390/cancers14102562. PMID: 35626166.
- Preclinical in vivo validation of the RAD51 test for identification of homologous recombination-deficient tumors and patient stratification. Pellegrino B, Herencia-Ropero A, Llop-Guevara A, Pedretti F, Moles-Fernández A, Viaplana C, Villacampa G, Guzmán M, Rodríguez O, Grueso J, Jimenez J, Arenas EJ, Degasperi A, Dias JML, Forment JV, O’Connor MJ, Déas O, Cairo S, Zhou Y, Musolino A, Caldas C, Nik-Zainal S, Clarke RB, Nuciforo P, Díez O, Serres-Créixams X, Peg V, Espinosa-Bravo M, Macarulla T, Oaknin A, Mateo J, Arribas J, Dienstmann R, Bellet M, Oliveira M, Saura C, Gutiérrez-Enríquez S, Balmaña J*, Serra V*. Cancer Research, 2022 Apr 15;82(8):1646-1657. Doi: 10.1158/0008-5472.CAN-21-2409. PMID: 35425960. IF: 12.701
- Anti-tumoural activity of the G-quadruplex ligand pyridostatin against BRCA1/2-deficient tumours. Groelly FJ, Porru M, Zimmer J, Benainous H, De Visser Y, Kosova AA, Di Vito S, Serra V, Ryan A, Leonetti C, Bruna A, Biroccio A, Tarsounas M. EMBO Mol Med. 2022 Mar 7;14(3):e14501. doi: 10.15252/emmm.202114501. PMID: 35107878.
- High FGFR1-4 mRNA expression levels correlate with response to selective FGFR inhibitors in breast cancer. Sánchez-Guixé M, Hierro C, Jiménez J, Viaplana C, Villacampa G, Monelli E, Brasó-Maristany F, Ogbah Z, Parés M, Guzmán M, Grueso J, Rodriguez O, Oliveira M, Azaro A, Garralda E, Tabernero J, Casanovas O, Scaltriti M, Prat A, Dienstmann R, Nuciforo P, Saura C, Graupera M, Vivancos A, Rodon J, Serra V. Clin Cancer Res. 2022 Jan 1;28(1):137-149. doi: 10.1158/1078-0432.CCR-21-1810. PMID: 34593528.
- INK4 tumor suppressor proteins mediate resistance to CDK4/6 kinase inhibitors. Li Q, Jiang B, Guo J, Shao H, Del Priore IS, Chang Q, Kudo R, Li Z, Razavi P, Liu B, Boghossian AS, Rees MG, Ronan MM, Roth JA, Donovan KA, Palafox M, Reis-Filho JS, de Stanchina E, Fischer ES, Rosen N, Serra V, Koff A, Chodera JD, Gray NS, Chandarlapaty S. Cancer Discov. 2021 Sep 20:candisc.1726.2020. doi: 10.1158/2159-8290.CD-20-1726. PMID: 34544752.
- Association of RAD51 with homologous recombination deficiency (HRD) and clinical outcomes in untreated triple-negative breast cancer (TNBC): analysis of the GeparSixto randomized clinical trial. Llop-Guevara A, Loibl S, Villacampa G, Vladimirova V, Schneeweiss A, Karn T, Zahm DM, Herencia-Ropero A, Jank P, van Mackelenbergh M, Fasching PA, Marmé F, Stickeler E, Schem C, Dienstmann R, Florian S, Nekljudova V, Balmaña J, Hahnen E, Denkert C, Serra V. Ann Oncol. 2021 Sep 11:S0923-7534(21)04478-1. doi: 10.1016/j.annonc.2021.09.003. PMID: 34520831.
- Clinical consequences of BRCA2 hypomorphism. Castells-Roca L, Gutiérrez-Enríquez S, Bonache S, Bogliolo M, Carrasco E, Aza-Carmona M, Montalban G, Muñoz-Subirana N, Pujol R, Cruz C, Llop-Guevara A, Ramírez MJ, Saura C, Lasa A, Serra V, Diez O, Balmaña J, Surrallés J. NPJ Breast Cancer. 2021 Sep 9;7(1):117. doi: 10.1038/s41523-021-00322-9. PMID: 34504103.
- Synergistic targeting of BRCA1 mutated breast cancers with PARP and CDK2 inhibition. Aziz D, Portman N, Fernandez KJ, Lee C, Alexandrou S, Llop-Guevara A, Phan Z, Yong A, Wilkinson A, Sergio CM, Ferraro D, Etemadmoghadam D, Bowtell DD; kConFab Investigators, Serra V, Waring P, Lim E, Caldon CE. NPJ Breast Cancer. 2021 Aug 31;7(1):111. doi: 10.1038/s41523-021-00312-x. PMID: 34465787.
- Biomarkers Associating with PARP Inhibitor Benefit in Prostate Cancer in the TOPARP-B Trial. Carreira S, Porta N, Arce-Gallego S, Seed G, Llop-Guevara A, Bianchini D, Rescigno P, Paschalis A, Bertan C, Baker C, Goodall J, Miranda S, Riisnaes R, Figueiredo I, Ferreira A, Pereira R, Crespo M, Gurel B, Nava Rodrigues D, Pettitt SJ, Yuan W, Serra V, Rekowski J, Lord CJ, Hall E, Mateo J, de Bono JS. Cancer Discov. 2021 May 27:candisc.0007.2021. doi: 10.1158/2159-8290.CD-21-0007. Online ahead of print. PMID: 34045297.
- Wright SCE, Vasilevski N, Serra V, Rodon J, Eichhorn PJA. Mechanisms of Resistance to PI3K Inhibitors in Cancer: Adaptive Responses, Drug Tolerance and Cellular Plasticity. Cancers (Basel). 2021 Mar 26;13(7):1538. doi: 10.3390/cancers13071538. PMID: 33810522.
- Gris-Oliver A, Ibrahim YH, Rivas MA, García-García C, Sánchez-Guixé M, Ruiz- Pace F, Viaplana C, Pérez-García JM, Llombart-Cussac A, Grueso J, Parés M, Guzmán M, Rodríguez O, Anton P, Cozar P, Calvo MT, Bruna A, Arribas J, Caldas C, Dienstmann R, Nuciforo P, Oliveira M, Cortés J, Serra V. PI3K activation promotes resistance to eribulin in HER2-negative breast cancer. Br J Cancer. 2021 Mar 15. doi: 10.1038/s41416-021-01293-1. PMID: 33723394
- Georgopoulou D, Callari M, Rueda OM, Shea A, Martin A, Giovannetti A, Qosaj F, Dariush A, Chin SF, Carnevalli LS, Provenzano E, Greenwood W, Lerda G, Esmaeilishirazifard E, O’Reilly M, Serra V, Bressan D; IMAXT Consortium, Mills GB, Ali HR, Cosulich SS, Hannon GJ, Bruna A, Caldas C. Landscapes of cellular phenotypic diversity in breast cancer xenografts and their impact on drug response. Nat Commun. 2021 Mar 31;12(1):1998. doi: 10.1038/s41467-021-22303-z. PMID: 33790302; PMCID: PMC8012607.
- Eikesdal HP, Yndestad S, Elzawahry A, Llop-Guevara A, Gilje B, Blix ES, Espelid H, Lundgren S, Geisler J, Vagstad G, Venizelos A, Minsaas L, Leirvaag B, Gudlaugsson EG, Vintermyr OK, Aase HS, Aas T, Balmaña J, Serra V, Janssen EAM, Knappskog S, Lønning PE. Olaparib monotherapy as primary treatment in unselected triple negative breast cancer. Ann Oncol. 2021 Feb;32(2):240-249. doi: 10.1016/j.annonc.2020.11.009. Epub 2020 Nov 24. PMID: 33242536.
- Woo XY, Giordano J, Srivastava A, Zhao ZM, Lloyd MW, de Bruijn R, Suh YS, Patidar R, Chen L, Scherer S, Bailey MH, Yang CH, Cortes-Sanchez E, Xi Y, Wang J, Wickramasinghe J, Kossenkov AV, Rebecca VW, Sun H, Mashl RJ, Davies SR, Jeon R, Frech C, Randjelovic J, Rosains J, Galimi F, Bertotti A, Lafferty A, O’Farrell AC, Modave E, Lambrechts D, Ter Brugge P, Serra V, Marangoni E, El Botty R, Kim H, Kim JI, Yang HK, Lee C, Dean DA 2nd, Davis-Dusenbery B, Evrard YA, Doroshow JH, Welm AL, Welm BE, Lewis MT, Fang B, Roth JA, Meric-Bernstam F, Herlyn M, Davies MA, Ding L, Li S, Govindan R, Isella C, Moscow JA, Trusolino L, Byrne AT, Jonkers J, Bult CJ, Medico E, Chuang JH; PDXNET Consortium; EurOPDX Consortium. Conservation of copy number profiles during engraftment and passaging of patient-derived cancer xenografts. Nat Genet. 2021 Jan;53(1):86-99. doi: 10.1038/s41588-020-00750-6. Epub 2021 Jan 7. PMID: 33414553.
- Méndez-Pertuz M, Martínez P, Blanco-Aparicio C, Gómez-Casero E, Belen García A, Martínez-Torrecuadrada J, Palafox M, Cortés J, Serra V, Pastor J, Blasco MA. Modulation of telomere protection by the PI3K/AKT pathway. Nat Commun. 2017 Nov 2;8(1):1278.
- Zabala-Letona A, Arruabarrena-Aristorena A, Martín-Martín N, (…), Serra V, (…), Carracedo A. mTORC1-dependent AMD1 regulation sustains polyamine metabolism in prostate cancer. Nature. 2017 Jul 6;547(7661):109-113.
- Hierro C, Alsina M, Sánchez M, Serra V, Rodon J, Tabernero J. Targeting the fibroblast growth factor receptor 2 in gastric cancer: promise or pitfall? Ann Oncol. 2017 Jun 1;28(6):1207-1216.
- Byrne AT, Alférez DG, Amant F, Annibali D, Arribas J, Biankin AV, Bruna A, Budinská E, Caldas C, Chang DK, Clarke RB, Clevers H, Coukos G, Dangles-Marie V, Eckhardt SG, Gonzalez-Suarez E, Hermans E, Hidalgo M, Jarzabek MA, de Jong S, Jonkers J, Kemper K, Lanfrancone L, Mælandsmo GM, Marangoni E, Marine JC, Medico E, Norum JH, Palmer HG, Peeper DS, Pelicci PG, Piris-Gimenez A, Roman-Roman S, Rueda OM, Seoane J, Serra V, Soucek L, Vanhecke D, Villanueva A, Vinolo E, Bertotti A, Trusolino L. Interrogating open issues in cancer precision medicine with patient-derived xenografts Interrogating open issues in cancer precision medicine with Patient-Derived Xenografts. Nat Rev Cancer. 2017 Apr; 17(4):254-268.
- CDK12 inhibition reverses de novo and acquired PARP inhibitor resistance in BRCA wild-type and mutated models of triple-negative breast cancer. Johnson SF, Cruz C, Greifenberg AK, Dust S, Stover DG, Chi D, Primack B, Cao S, Bernhardy AJ, Coulson R, Lazaro JB, Kachupurakkal B, Sun H, Unitt C, Moreau LA, Sarosiek KA, Scaltriti M, Juric D, Baselga J, Richardson AL, Rodig SJ, D’Andrea AD, Balmaña J, Johnson N, Geyer M, Serra V, Lim E, Shapiro GI. Cell Reports. Nov 22;17(9):2367-2381. doi: 10.1016/j.celrep.2016.10.077. IF: 7.870
- PIM1 kinase regulates cell death, tumor growth and chemotherapy response in triple-negative breast cancer. Brasó-Maristany F, Filosto S, Catchpole S, Marlow R, Quist J, Francesch-Domenech E, Plumb DA, Zakka L, Gazinska P, Liccardi G, Meier P, Gris-Oliver A, Cheang MCU, Perdrix-Rosell A, Shafat M, Noël E, Patel N, McEachern K, Scaltriti M, Castel P, Noor F, Buus R, Mathew S, Watkins J, Serra V, Marra P, Grigoriadis A & Tutt AN. Nat Med. Nov;22(11):1303-1313. IF: 30.357.
- A Biobank of Breast Cancer Explants with Preserved Intra-tumor Heterogeneity to Screen Anticancer Compounds. Bruna A, Rueda OM, Greenwood W, Batra AS, Callari M, Batra RN, Pogrebniak K, Sandoval J, Cassidy JW, Tufegdzic-Vidakovic A, Sammut SJ, Jones L, Provenzano E, Baird R, Eirew P, Hadfield J, Eldridge M, McLaren-Douglas A, Barthorpe A, Lightfoot H, O’Connor MJ, Gray J, Cortes J, Baselga J, Marangoni E, Welm AL, Aparicio S, Serra V, Garnett MJ, Caldas C. Cell. 2016 Sep 22;167(1):260-274.e22. IF: 28.710.
- Gain- and Loss-of-Function Mutations in the Breast Cancer Gene GATA3 Result in Differential Drug Sensitivity. Mair B, Konopka T, Kerzendorfer C, Sleiman K, Salic S, Serra V, Muellner MK, Theodorou V, Nijman SM. PLoS Genet. 2016 Sep 2;12(9):e1006279. IF: 7.528.
- Stratification and therapeutic potential of PML in metastatic breast cancer. Martín-Martín N, Piva M, Urosevic J, Aldaz P, Sutherland JD, Fernández-Ruiz S, Arreal L, Torrano V, Cortazar AR, Planet E, Guiu M, Radosevic-Robin N, Garcia S, Macías I, Salvador F, Domenici G, Rueda OM, Zabala-Letona A, Arruabarrena-Aristorena A, Zúñiga-García P, Caro-Maldonado A, Valcárcel-Jiménez L, Sánchez-Mosquera P, Varela-Rey M, Martínez-Chantar ML, Anguita J, Ibrahim YH, Scaltriti M, Lawrie CH, Aransay AM, Iovanna JL, Baselga J, Caldas C, Barrio R, Serra V, Vivanco Md, Matheu A, Gomis RR, Carracedo A. Nat Commun. 2016 Aug 24;7:12595. IF: 11.329.
- Cancer network activity associated with therapeutic response and synergism. Serra-Musach J, Mateo F, Capdevila-Busquets E, de Garibay GR, Zhang X, Guha R, Thomas CJ, Grueso J, Villanueva A, Jaeger S, Heyn H, Vizoso M, Pérez H, Cordero A, Gonzalez-Suarez E, Esteller M, Moreno-Bueno G, Tjärnberg A, Lázaro C, Serra V, Arribas J, Benson M, Gustafsson M, Ferrer M, Aloy P, Pujana MÀ. Genome Med. 2016 Aug 24;8(1):88. IF: 5.850.
- BRCA1185delAG tumors may acquire therapy resistance through expression of RING-less BRCA1. Drost R, Dhillon KK, van der Gulden H, van der Heijden I, Brandsma I, Cruz C, Chondronasiou D, Castroviejo-Bermejo M, Boon U, Schut E, van der Burg E, Wientjens E, Pieterse M, Klijn C, Klarenbeek S, Loayza-Puch F, Elkon R, van Deemter L, Rottenberg S, van de Ven M, Dekkers DH, Demmers JA, van Gent DC, Agami R, Balmaña J, Serra V, Taniguchi T, Bouwman P, Jonkers J. J Clin Invest. 2016 Jul 25. pii: 70196. IF: 12.575.
- Early adaptation and acquired resistance to CDK4/6 inhibition in estrogen receptor positive breast cancer. Herrera-Abreu M, Palafox M, Asghar U, Rivas MA, Cutts RJ, Garcia-Murillas I, Pearson A, Guzman M, Rodriguez O, Grueso J, Bellet M, Cortés J, Elliott R, Pancholi S, Baselga J, Dowsett M, Martin LA, Turner NC, Serra V*. Cancer Res. 2016 Apr 1;76(8):2301-13. IF: 9.329.
- The BRCA1-Δ11q Alternative Splice Isoform Bypasses Germline Mutations and Promotes Therapy Resistance. Wang Y, Bernhardy AB, Cruz C, Krais JJ, Nacson J, Nicolas E, Peri S, van der Gulden H, van der Heiiden I, O’Brien SW, Zhang Y, Harrell MI, Johnson SF, Candido Dos Reis FJ, Pharoah PDP, Karlan B, Gourley C, Lambrechts D, Chenevix-Trench G, Olsson H, Benitez JJ, Greene MH, Gore M, Nussbaum R, Sadetzki S, Gayther SA, Kjaer SK, kConFab Investigators, D’Andrea AD, Shapiro GI, Wiest DL, Connolly DC, Daly MB, Swisher EM, Bouwman P, Jonkers J, Balmaña J, Serra V and Johnson N. Cancer Res. 2016, May 1;76(9):2778-90. IF: 9.329.
- Scaltriti M, Nuciforo P, Bradbury I, Sperinde J, Agbor-Tarh D, Campbell C, Chenna A, Winslow J, Serra V, Parra JL, Prudkin L, Jimenez J, Aura C, Harbeck N, Pusztai L, Ellis C, Eidtmann H, Arribas J, Cortes J, de Azambuja E, Piccart M, Baselga J. High HER2 expression correlates with response to the combination of lapatinib and trastuzumab. Clin. Cancer Res. 2015 Feb; 21(3): 569-76
- Ugalde-Olano A, Egia A, Fernández-Ruiz S, Loizaga-Iriarte A, Zuñiga-García P, Garcia S, Royo F, Lacasa-Viscasillas I, Castro E, Cortazar AR, Zabala-Letona A, Martín-Martín N, Arruabarrena-Aristorena A, Torrano-Moya V, Valcárcel-Jiménez L, Sánchez-Mosquera P, Caro-Maldonado A, González-Tampan J, Cachi-Fuentes G, Bilbao E, Montero R, Fernández S, Arrieta E, Zorroza K, Castillo-Martín M, Serra V, Salazar E, Macías-Cámara N, Tabernero J, Baselga J, Cordon-Cardo C, Aransay AM, Villar AD, Iovanna JL, Falcón-Pérez JM, Unda M, Bilbao R, Carracedo A. Methodological aspects of the molecular and histological study of prostate cancer: focus on PTEN. Methods 2015 May; 77-78: 25-30
- García-García C, Rivas MA, Ibrahim YH, Calvo MT, Gris-Oliver A, Rodriguez O, Grueso J, Anton P, Guzman M, Aura C, Nuciforo P, Jessen K, Argiles G, Dienstmann R, Bertotti A, Trusolino L, Matito J, Vivancos A, Chicote I, Pálmer HG, Tabernero J, Scaltriti M, Baselga J, Serra V. MEK plus PI3K/mTORC1/2 Therapeutic Efficacy Is Impacted by TP53 Mutation in Preclinical Models of Colorectal Cancer. Clin. Cancer Res. 2015 Dec; 21(24): 5499-510
- Bosch A, Li Z, Bergamaschi A, Ellis H, Toska E, Prat A, Tao JJ, Spratt DE, Viola-Villegas NT, Castel P, Minuesa G, Morse N, Rodón J, Ibrahim Y, Cortes J, Pérez-García J, Galván P, Grueso J, Guzman M, Katzenellenbogen JA, Kharas M, Lewis JS, Dickler M, Serra V, Rosen N, Chandarlapaty S, Scaltriti M, Baselga J. PI3K inhibition results in enhanced estrogen receptor function and dependence in hormone receptor-positive breast cancer. Sci Transl Med 2015 Apr; 7(283): 283ra51
- Muellner MK, Mair B, Ibrahim Y, Kerzendorfer C, Lechtermann H, Trefzer C, Klepsch F, Müller AC, Leitner E, Macho-Maschler S, Superti-Furga G, Bennett KL, Baselga J, Rix U, Kubicek S, Colinge J, Serra V, Nijman SM. Targeting a cell state common to triple-negative breast cancers. Mol. Syst. Biol. 2015 Jan; 11(1): 789
- Parra-Palau JL, Morancho B, Peg V, Escorihuela M, Scaltriti M, Vicario R, Zacarias-Fluck M, Pedersen K, Pandiella A, Nuciforo P, Serra V, Cortes J, Baselga J, Perou CM, Prat A, Rubio IT, Arribas J. Effect of p95HER2/611CTF on the response to trastuzumab and chemotherapy. J. Natl. Cancer Inst. 2014 Nov; 106(11)
- Dienstmann R, Rodón J, Serra V, Tabernero J. Picking the point of inhibition: a comparative review of PI3K/AKT/mTOR pathway inhibitors. Mol. Cancer Ther. 2014 May; 13(5): 1021-31
- Rodón J, Dienstmann R, Serra V, Tabernero J. Development of PI3K inhibitors: lessons learned from early clinical trials. Nat Rev Clin Oncol 2013 Mar; 10(3): 143-53
Yan Y, Serra V, Prudkin L, Scaltriti M, Murli S, Rodriguez O, Guzman M, Sampath D, Nannini M, Xiao Y, Wagle MC, Wu JQ, Wongchenko M, Hampton G, Ramakrishnan V, Lackner MR, Saura C, Roda D, Cervantes A, Tabernero J, Patel P, Baselga J. Evaluation and clinical analyses of downstream targets of the Akt inhibitor GDC-0068. Clin. Cancer Res. 2013 Dec; 19(24): 6976-86 - Serra V, Vivancos A, Puente XS, Felip E, Silberschmidt D, Caratù G, Parra JL, De Mattos-Arruda L, Grueso J, Hernandez-Losa J, Arribas J, Prudkin L, Nuciforo P, Scaltriti M, Seoane J, Baselga J. Clinical response to a lapatinib-based therapy for a Li-Fraumeni syndrome patient with a novel HER2V659E mutation. Cancer Discov 2013 Nov; 3(11): 1238-44
- Serra V, Eichhorn PJ, García-García C, Ibrahim YH, Prudkin L, Sánchez G, Rodriguez O, Anton P, Parra JL, Marlow S, Scaltriti M, Pérez-García J, Prat A, Arribas J, Hahn WC, Kim SY, Baselga J. RSK3/4 mediate resistance to PI3K pathway inhibitors in breast cancer. J. Clin. Invest. 2013 Jun; 123(6): 2551-63
- Elkabets M, Vora S, Juric D, Morse N, Mino-Kenudson M, Muranen T, Tao J, Campos AB, Rodón J, Ibrahim YH, Serra V, Rodrik-Outmezguine V, Hazra S, Singh S, Kim P, Quadt C, Liu M, Huang A, Rosen N, Engelman JA, Scaltriti M, Baselga J. mTORC1 inhibition is required for sensitivity to PI3K p110α inhibitors in PIK3CA-mutant breast cancer. Sci Transl Med 2013 Jul; 5(196): 196ra99
- Ibrahim YH, García-García C, Serra V, He L, Torres-Lockhart K, Prat A, Anton P, Cozar P, Guzman M, Grueso J, Rodriguez O, Calvo MT, Aura C, Diez O, Rubio IT, Pérez J, Rodón J, Cortes J, Ellisen LW, Scaltriti M, Baselga J. PI3K inhibition impairs BRCA1/2 expression and sensitizes BRCA-proficient triple-negative breast cancer to PARP inhibition. Cancer Discov 2012 Nov; 2(11): 1036-47
- García-García C, Ibrahim YH, Serra V, Calvo MT, Guzman M, Grueso J, Aura C, Pérez J, Jessen K, Liu Y, Rommel C, Tabernero J, Baselga J, Scaltriti M. Dual mTORC1/2 and HER2 blockade results in antitumor activity in preclinical models of breast cancer resistant to anti-HER2 therapy. Clin. Cancer Res. 2012 May; 18(9): 2603-12
- Serra V, Scaltriti M, Prudkin L, Eichhorn PJ, Ibrahim YH, Chandarlapaty S, Markman B, Rodriguez O, Guzman M, Rodriguez S, Gili M, Russillo M, Parra JL, Singh S, Arribas J, Rosen N, Baselga J. PI3K inhibition results in enhanced HER signaling and acquired ERK dependency in HER2-overexpressing breast cancer. Oncogene 2011 Jun; 30(22): 2547-57
- Scaltriti M, Eichhorn PJ, Cortes J, Prudkin L, Aura C, Jimenez J, Chandarlapaty S, Serra V, Prat A, Ibrahim YH, Guzman M, Gili M, Rodriguez O, Rodriguez S, Pérez J, Green SR, Mai S, Rosen N, Hudis C, Baselga J. Cyclin E amplification/overexpression is a mechanism of trastuzumab resistance in HER2+ breast cancer patients. Proc. Natl. Acad. Sci. U.S.A. 2011 Mar; 108(9): 3761-6
- Scaltriti M, Serra V, Normant E, Guzman M, Rodriguez O, Lim AR, Slocum KL, West KA, Rodriguez V, Prudkin L, Jimenez J, Aura C, Baselga J. Antitumor activity of the Hsp90 inhibitor IPI-504 in HER2-positive trastuzumab-resistant breast cancer. Mol. Cancer Ther. 2011 May; 10(5): 817-24
- Chandarlapaty S, Sawai A, Scaltriti M, Rodrik-Outmezguine V, Grbovic-Huezo O, Serra V, Majumder PK, Baselga J, Rosen N. AKT inhibition relieves feedback suppression of receptor tyrosine kinase expression and activity. Cancer Cell 2011 Jan; 19(1): 58-71
Título del Proyecto: “Desarrollo de nuevas estrategias terapéuticas para superar la resistencia a los inhibidores de CDK4/6 en cánceres de mama con expresión del receptor de estrógenos” (PI20/00892)
Investigadoras Principales: Violeta Serra & M. Bellet
Entidad Financiadora: ISCIII-Project Grant
Duración: 2021-2023
Título del Proyecto: “PARPiPRED, prueba diagnóstica que facilita la medicina personalizada en el tratamiento del cáncer” (2019PROD00045)
Investigadora Principal: Violeta Serra
Agencia Financiadora: AGAUR-Producte
Duración: 2020-2021
Este proyecto ha sido cofinanciado por la Unión Europea a través del Fondo Europeo de Desarrollo Regional (FEDER) y cuenta con el apoyo de la Secretaria d’Universitats i Recerca del Departament d’Empresa i Coneixement de la Generalitat de Catalunya.

Título del proyecto: “RAD51predict: estratificación de pacientes basada en la funcionalidad de reparación del ADN para la medicina de precisión del cáncer” (ERAPERMED2019-215)
Coordinadora: Violeta Serra
Agencia financiadora: ERA Net- Era PerMed
Instituciones asociadas: Universidad de Marburg, Institut Gustave Roussy, German Breast Group, CHU de Québec-Laval
Duración: 2020-2022
Título del Proyecto: “Biopsias líquidas para la identificación de mecanismos de resistencia a inhibidores de PARP en cánceres asociados a BRCA1/2” (654/C/2019)
Coordinadora: Violeta Serra
Agencia Financiadora: La Marató TV3
Instituciones colaboradoras: IRB Lleida
Duración: 2020-2022
Título del proyecto: “Modulación de la señalización del receptor de andrógenos como estrategia terapéutica para el cáncer de mama metastásico con receptor de estrógeno positivo” (2018NovPCC1291)
Investigadora Principal: Violeta Serra
Agencia financiadora: Breast Cancer Now- Catalyst
Duración: 2019-2021
Título del proyecto: “PARPiPRED: una prueba diagnóstica complementaria para posibilitar la medicina personalizada en cáncer” (CaixaImpulse Consolidate, CF91-00008)
Investigadora Principal: A. Llop
Entidad Financiadora: Fundación La Caixa
Duración: 2020-2021
Título del proyecto: “Cualificación clínica de los defectos de reparación del ADN como biomarcadores en el cáncer de próstata metastásico mediante genómica integrada y ensayos funcionales basados en tejidos” (PC170510P1)
Coordinadores: J. Mateo
Agencia financiadora: Departamento de Defensa, EE. UU.
Duración: 2018-2021
Título del Proyecto: “MESI-STRAT: Medicina de Sistemas de Redes de Señalización Metabólica-Un Nuevo Concepto para la Estratificación de Pacientes con Cáncer de Mama” (754688)
Convocatoria: H2020-SC1-2016-2017 (Medicina Personalizada)
Tema: SC1-PM-02-2017
Coordinador: Prof. K. Thedieck, UMCG, NL
Agencia Financiadora: Comisión Europea
Duración: 2018-2022













