
Las inmunoterapias contra el cáncer aprovechan el sistema inmunitario para atacar la enfermedad. Los estudios clínicos han demostrado que los inhibidores de los puntos de control inmunitarios y los tratamientos a partir de linfocitos T pueden intervenir en la regresión del tumor en pacientes con enfermedad metastásica. Así, pues, además de la cirugía, la radioterapia y la quimioterapia, la inmunoterapia representa cada vez más el cuarto pilar del tratamiento oncológico. Nuestro grupo se centra en conocer mejor la respuesta natural de los linfocitos T al cáncer y determinar maneras de aprovechar estas respuestas antitumorales para desarrollar inmunoterapias contra el cáncer más eficaces, potentes y personalizadas.
Cada vez hay más pruebas de que los neoantígenos tienen un papel importante en la eficacia clínica de las inmunoterapias contra el cáncer. Para ello, y gracias al apoyo recibido del Programa Integral de Inmunoterapia e Inmunología del Cáncer (CAIMI) de la Fundación BBVA en el VHIO, así como de otras agencias financiadoras, y a través de la colaboración de muchos años de nuestro grupo con Elena Garralda, investigadora principal del Grupo de Desarrollo Clínico Precoz de Fármacos del VHIO y directora de nuestra Unidad de Investigación de Terapia Molecular del Cáncer (UITM)-CaixaResearch, recibimos la autorización de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en mayo de 2021 para iniciar un ensayo clínico de fase I para probar la seguridad y tolerabilidad de TILs reactivos a neoantígenos seleccionados.
En este ensayo clínico en curso estamos utilizando un enfoque muy personalizado (véase la figura) para detectar el reconocimiento mediado por linfocitos T de antígenos mutados a través de células presentadoras de antígenos autólogas que pueden procesar y presentarse en todo el antígeno leucocitario humano (HLA) posible. En este estudio clínico piloto financiado por el Instituto de Salud Carlos III-ISCIII, pretendemos tratar hasta 10 pacientes con cánceres epiteliales y melanoma resistentes a los tratamientos de referencia. Mediante el enriquecimiento de linfocitos reactivos a neoantígenos, esperamos ampliar la eficacia del tratamiento con TILs más allá del melanoma.
Los trabajos de nuestro grupo han demostrado que los linfocitos T reactivos a tumores pueden detectarse con frecuencia circulando en la sangre de pacientes con cáncer, independientemente del tipo específico de tumor. La capacidad de rastrear y monitorizar los linfocitos T CD8+ y CD4+ reactivos a tumores en sangre tiene un enorme potencial terapéutico, pero resulta más difícil debido a su menor prevalencia. Nuestro grupo ha contribuido a definir una firma fenotípica que puede guiar la identificación y el enriquecimiento de linfocitos T reactivos a tumores y neoantígenos a partir de la sangre de pacientes con cáncer, y nuestro objetivo es aprovecharla para desarrollar tratamientos de linfocitos T mínimamente invasivos para tratar a pacientes con cáncer. Ahora también nos proponemos llevar a cabo un perfil exhaustivo de la respuesta de los linfocitos T de sangre periférica a escala unicelular en pacientes tratados con inhibidores de puntos de control inmunitarios para comprender mejor los factores determinantes de la respuesta.
Además de lo anterior, nuestro grupo también está interesado en desarrollar tecnologías de alto rendimiento para comprender mejor el panorama de los antígenos tumorales que hacen que los tumores sean susceptibles al ataque inmunitario, los neoantígenos compartidos, así como los mecanismos de resistencia a la citotoxicidad de los linfocitos T.
- Caracterizar la respuesta de los linfocitos T antitumorales personalizados en pacientes con cáncer.
- Analizar el repertorio personalizado de linfocitos reactivos al tumor para detectar posibles biomarcadores de respuesta a la inmunoterapia contra el cáncer.
- Investigar nuevas estrategias para identificar más rápidamente los linfocitos reactivos al tumor, así como los antígenos diana que impulsan esta respuesta.
- Estudiar los mecanismos intrínsecos de resistencia a la citotoxicidad mediada por linfocitos T de las células tumorales.
- Desarrollar inmunoterapias oncológicas personalizadas basadas en linfocitos T para pacientes con tumores sólidos.
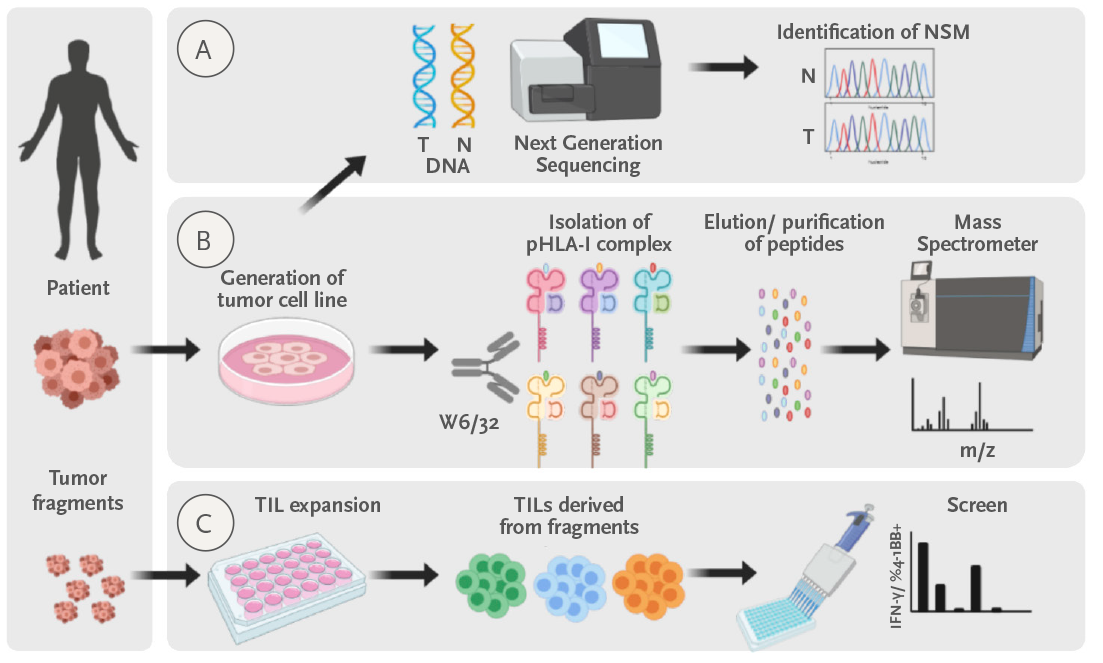
Figura: Enfoque personalizado para identificar LIT específicos del tumor y el neoantígeno. a) Secuenciamos el ADN normal y el tumoral para identificar todas las mutaciones no sinónimas. b) Paralelamente, intentamos generar una línea celular del tumor. Cuando se generan, aislamos los complejos péptido-CMH I e identificamos los péptidos que el CMH I presenta por línea celular del tumor por espectrometría de masas. c) Por último, examinamos los LIT expandidos a partir del tumor para reconocer los péptidos neoantígenos candidatos identificados en a) o eluidos del MHCI en b).
Jefa de grupo
Alena Gros
Becarios postdoctorales
Jara Palomero
Pierre Levy
María Lozano
Endika Prieto
Estudiantes de postgrado
Judit Díaz
Anna Yuste
Andrea García
Técnicos
Albert Marín
Immaculada Creus
Lab Manager
Noelia Alcazar
Bioinformático
Jonatan González
Estudiantes
Alisha Atmopawiro
Carla Brujas
- Marin I, Boix O, Garcia-Garijo A, Sirois I, Caballe A, Zarzuela E, Ruano I, Stephan-Otto Attolini C, Prats N, Lopez-Dominguez JA, Kovatcheva M, Garralda E, Munoz J, Caron E, Abad M, Gros A, Pietrocola F, Serrano M. Cellular senescence is immunogenic and promotes anti-tumor immunity. Cancer Discov. Epub 2022 Oct 27.
- Palomero J, Panisello C, Lozano-Rabella M, Tirtakasuma R, Díaz-Gómez J, Grases D, Pasamar H, Arregui L, Dorca Duch E, Guerra Fernández E, Vivancos A, de Andrea CE, Melero I, Ponce J, Vidal A, Piulats JM, Matias-Guiu X, Gros A. Biomarkers of tumor-reactive CD4+ and CD8+ TILs associate with improved prognosis in endometrial cancer. J Immunother Cancer. 2022 Dec;10(12):e005443. doi: 10.1136/jitc-2022-005443. PMID: 36581331; PMCID: PMC9806064.
- Levy PL, Gros A. Fast track to personalized TCR T cell therapies. Cancer Cell. 2022 May 9;40(5):447-449.
- Marin I, Boix O, Garcia-Garijo A, Sirois I, Caballe A, Zarzuela E, Ruano I, Stephan-Otto Attolini C, Prats N, Lopez-Dominguez JA, Kovatcheva M, Garralda E, Munoz J, Caron E, Abad M, Gros A, Pietrocola F, Serrano M. Cellular senescence is immunogenic and promotes anti-tumor immunity. Cancer Discov. Epub 2022 Oct 27.
- Palomero J, Panisello C, Lozano-Rabella M, Tirtakasuma R, Díaz-Gómez J, Grases D, Pasamar H, Arregui L, Dorca Duch E, Guerra Fernández E, Vivancos A, de Andrea CE, Melero I, Ponce J, Vidal A, Piulats JM, Matias-Guiu X, Gros A. Biomarkers of tumor-reactive CD4+ and CD8+ TILs associate with improved prognosis in endometrial cancer. J Immunother Cancer. 2022 Dec;10(12):e005443. doi: 10.1136/jitc-2022-005443. PMID: 36581331; PMCID: PMC9806064.
- Levy PL, Gros A. Fast track to personalized TCR T cell therapies. Cancer Cell. 2022 May 9;40(5):447-449.
- Gartner JJ, Parkhurst MR, Gros A, Tran E, Jafferji MS, Copeland A, Hanada KI, Zacharakis N, Lalani A, Krishna S, Sachs A, Prickett TD, Li YF, Florentin M, Kivitz S, Chatmon SC, Rosenberg SA, Robbins PF. A machine learning model for ranking candidate HLA class I neoantigens based on known neoepitopes from multiple human tumor types. Nat Cancer. 2021 May;2(5):563-574.
- Arenas EJ, Martínez-Sabadell A, Rius Ruiz I, Román Alonso M, Escorihuela M, Luque A, Fajardo CA, Gros A, Klein C, Arribas J. Acquired cancer cell resistance to T cell bispecific antibodies and CAR T targeting HER2 through JAK2 down-modulation. Nat Commun. 2021 Feb 23;12(1):1237.
- Kast F, Klein C, Umaña P, Gros A, Gasser S. Advances in identification and selection of personalized neoantigen/T-cell pairs for autologous adoptive T cell therapies. Oncoimmunology. 2021 Jan 7;10(1):1869389.
- Arenas EJ, Martínez-Sabadell A, Rius Ruiz I, Román Alonso M, Escorihuela M, Luque A, Fajardo CA, Gros A, Klein C, Arribas J. Acquired cancer cell resistance to T cell bispecific antibodies and CAR T targeting HER2 through JAK2 down-modulation. Nat Commun. 2021 Feb 23;12(1):1237. doi: 10.1038/s41467-021-21445-4. PMID: 33623012; PMCID: PMC7902842.
- Kast F, Klein C, Umaña P, Gros A, Gasser S. Advances in identification and selection of personalized neoantigen/T-cell pairs for autologous adoptive T cell therapies. Oncoimmunology. 2021 Jan 7;10(1):1869389. doi: 10.1080/2162402X.2020.1869389. PMID: 33520408; PMCID: PMC7808433.
- Lozano-Rabella M, Gros A. TCR Repertoire Changes during TIL Expansion: Clonal Selection or Drifting? Clin Cancer Res. 2020 Aug 15;26(16):4177-4179
- Gros A, Tran E, Parkhurst MR, Ilyas S, Pasetto A, Groh EM, Robbins PF, Yossef R, Garcia-Garijo A, Fajardo CA, Prickett TD, Jia L, Gartner JJ, Ray S, Ngo L, Wunderllich JR, Yang JC, Rosenberg SA. Recognition of human gastrointestinal cancer neoantigens by circulating PD-1+ lymphocytes. J Clin Invest. 2019 Nov 1;129(11):4992-5004.
- Garcia-Garijo A, Fajardo CA, Gros A. Determinants for Neoantigen Identification. Front Immunol. 2019 Jun 24;10:1392.
- Yossef R, Tran E, Deniger DC, Gros A, Pasetto A, Parkhurst MR, Gartner JJ, Prickett TD, Cafri G, Robbins PF, Rosenberg SA. Enhanced detection of neoantigen-reactive T cells targeting unique and shared oncogenes for personalized cancer immunotherapy. JCI Insight. 2018 Oct 4;3(19). pii: 122467.
- R. Eil, S.K. Vodnala, D. Clever, C.A. Klebanoff, M.Sukumar, J.H. Pan, D.C. Palmer, A. Gros, T.N. Yamamoto, S.J. Patel, G.C. Guittard, Z. Yu, V. Carbonaro, K. Okkenhaug, D.S. Schrump, W.M. Linehan, R. Roychoudhuri, N.P. Restifo. Ionic immune suppression within the tumour microenvironment limits T cell effector function, Nature, 14 (2016) 539-543.
- A. Pasetto, A. Gros, P.F. Robbins, D.C. Deniger, R.D. Prickett, R. Matus-Nicodemos, D.C. Douek, B. Howie, H. Robins, M.R. Parkhurst, J. Gartner, K. Trebska-McGowan, J.S. Crystal, S.A. Rosenberg.Tumor- and Neoantigen-reactive T-cell receptors can be identified based on their frequency in fresh tumor.Cancer Immunol 2 (2016) 734-743.
- T.D. Prickett, J.S. Crystal, C.J. Cohen, A. Pasetto, M.R. Parkhurst, J.J. Gartner, X. Yao, R. Wang, A. Gros, Y.F. Li, M. El-Gamil, K. Trebska-McGowan, S.A. Rosenberg, P.F. Robbins, Durable Complete Response from Metastatic Melanoma after Transfer of Autologous T Cells Recognizing 10 Mutated Tumor Antigens, Cancer Immunol Res, (2016).
- C.A. Klebanoff, C.D. Scott, A.J. Leonardi, T.N. Yamamoto, A.C. Cruz, C. Ouyang, M. Ramaswamy, R. Roychoudhuri, Y. Ji, R.L. Eil, M. Sukumar, J.G. Crompton, D.C. Palmer, Z.A. Borman, D. Clever, S.K. Thomas, S. Patel, Z. Yu, P. Muranski, H. Liu, E. Wang, F.M. Marincola, A. Gros, L. Gattinoni, S.A. Rosenberg, R.M. Siegel, N.P. Restifo, Memory T cell-driven differentiation of naive cells impairs adoptive immunotherapy, J Clin Invest, 126 (2016) 318-334.
- A. Gros, M.R. Parkhurst, E. Tran, A. Pasetto, P.F. Robbins, S. Ilyas, T.D. Prickett, J.J. Gartner, J.S. Crystal, I.M. Roberts, K. Trebska-McGowan, J.R. Wunderlich, J.C. Yang, S.A. Rosenberg, Prospective identification of neoantigen-specific lymphocytes in the peripheral blood of melanoma patients, Nat Med, 22 (2016) 433-438.
- E. Tran, M. Ahmadzadeh, Y.C. Lu, A. Gros, S. Turcotte, P.F. Robbins, J.J. Gartner, Z. Zheng, Y.F. Li, S. Ray, J.R. Wunderlich, R.P. Somerville, S.A. Rosenberg, Immunogenicity of somatic mutations in human gastrointestinal cancers, Science, 350 (2015) 1387-1390.
- L.M. Draper, M.L. Kwong, A. Gros, S. Stevanovic, E. Tran, S. Kerkar, M. Raffeld, S.A. Rosenberg, C.S. Hinrichs, Targeting of HPV-16+ Epithelial Cancer Cells by TCR Gene Engineered T Cells Directed against E6, Clin Cancer Res, 21 (2015) 4431-4439.
- J.G. Crompton, M. Sukumar, R. Roychoudhuri, D. Clever, A. Gros, R.L. Eil, E. Tran, K. Hanada, Z. Yu, D.C. Palmer, S.P. Kerkar, R.D. Michalek, T. Upham, A. Leonardi, N. Acquavella, E. Wang, F.M. Marincola, L. Gattinoni, P. Muranski, M.S. Sundrud, C.A. Klebanoff, S.A. Rosenberg, D.T. Fearon, N.P. Restifo, Akt inhibition enhances expansion of potent tumor-specific lymphocytes with memory cell characteristics, Cancer Res, 75 (2015) 296-305.
- N. Acquavella, D. Clever, Z. Yu, M. Roelke-Parker, D.C. Palmer, L. Xi, H. Pflicke, Y. Ji, A. Gros, K. Hanada, I.S. Goldlust, G.U. Mehta, C.A. Klebanoff, J.G. Crompton, M. Sukumar, J.J. Morrow, Z. Franco, L. Gattinoni, H. Liu, E. Wang, F. Marincola, D.F. Stroncek, C.C. Lee, M. Raffeld, M.W. Bosenberg, R. Roychoudhuri, N.P. Restifo, Type I cytokines synergize with oncogene inhibition to induce tumor growth arrest, Cancer Immunol Res, 3 (2015) 37-47.
- S. Turcotte, A. Gros, E. Tran, C.C. Lee, J.R. Wunderlich, P.F. Robbins, S.A. Rosenberg, Tumor-Reactive CD8+ T Cells in Metastatic Gastrointestinal Cancer Refractory to Chemotherapy, Clin Cancer Res, 20 (2014) 331-343.
- E. Tran, S. Turcotte, A. Gros, P.F. Robbins, Y.C. Lu, M.E. Dudley, J.R. Wunderlich, R.P. Somerville, K. Hogan, C.S. Hinrichs, M.R. Parkhurst, J.C. Yang, S.A. Rosenberg, Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer, Science, 344 (2014) 641-645.
- A. Gros, P.F. Robbins, X. Yao, Y.F. Li, S. Turcotte, E. Tran, J.R. Wunderlich, A. Mixon, S. Farid, M.E. Dudley, K. Hanada, J.R. Almeida, S. Darko, D.C. Douek, J.C. Yang, S.A. Rosenberg, PD-1 identifies the patient-specific CD8(+) tumor-reactive repertoire infiltrating human tumors, J Clin Invest, 124 (2014) 2246-2259.
- S. Turcotte, A. Gros, K. Hogan, E. Tran, C.S. Hinrichs, J.R. Wunderlich, M.E. Dudley, S.A. Rosenberg, Phenotype and function of T cells infiltrating visceral metastases from gastrointestinal cancers and melanoma: implications for adoptive cell transfer therapy, J Immunol, 191 (2013) 2217-2225.
- R.A. Morgan, N. Chinnasamy, D. Abate-Daga, A. Gros, P.F. Robbins, Z. Zheng, M.E. Dudley, S.A. Feldman, J.C. Yang, R.M. Sherry, G.Q. Phan, M.S. Hughes, U.S. Kammula, A.D. Miller, C.J. Hessman, A.A. Stewart, N.P. Restifo, M.M. Quezado, M. Alimchandani, A.Z. Rosenberg, A. Nath, T. Wang, B. Bielekova, S.C. Wuest, N. Akula, F.J. McMahon, S. Wilde, B. Mosetter, D.J. Schendel, C.M. Laurencot, S.A. Rosenberg, Cancer regression and neurological toxicity following anti-MAGE-A3 TCR gene therapy, J Immunother, 36 (2013) 133-151.
- C. Puig-Saus, A. Gros, R. Alemany, M. Cascallo, Adenovirus i-leader truncation bioselected against cancer-associated fibroblasts to overcome tumor stromal barriers, Mol Ther, 20 (2012) 54-62.
- S. Guedan, D. Grases, J.J. Rojas, A. Gros, F. Vilardell, R. Vile, E. Mercade, M. Cascallo, R. Alemany, GALV expression enhances the therapeutic efficacy of an oncolytic adenovirus by inducing cell fusion and enhancing virus distribution, Gene Ther, 19 (2012) 1048-1057.
- A. Gros, S. Turcotte, J.R. Wunderlich, M. Ahmadzadeh, M.E. Dudley, S.A. Rosenberg, Myeloid cells obtained from the blood but not from the tumor can suppress T-cell proliferation in patients with melanoma, Clin Cancer Res, 18 (2012) 5212-5223.
- M. Gimenez-Alejandre, A. Gros, R. Alemany, Construction of capsid-modified adenoviruses by recombination in yeast and purification by iodixanol-gradient, Methods Mol Biol, 797 (2012) 21-34.
- L. Coughlan, S. Vallath, A. Gros, M. Gimenez-Alejandre, N. Van Rooijen, G.J. Thomas, A.H. Baker, M. Cascallo, R. Alemany, I.R. Hart, Combined fiber modifications both to target alpha(v)beta(6) and detarget the coxsackievirus-adenovirus receptor improve virus toxicity profiles in vivo but fail to improve antitumoral efficacy relative to adenovirus serotype 5, Hum Gene Ther, 23 (2012) 960-979.
- S. Guedan, J.J. Rojas, A. Gros, E. Mercade, M. Cascallo, R. Alemany, Hyaluronidase expression by an oncolytic adenovirus enhances its intratumoral spread and suppresses tumor growth, Mol Ther, 18 (2010) 1275-1283.
- A. Gros, C. Puig, S. Guedan, J.J. Rojas, R. Alemany, M. Cascallo, Verapamil enhances the antitumoral efficacy of oncolytic adenoviruses, Mol Ther, 18 (2010) 903-911.
- 22.- J.J. Rojas, M. Cascallo, S. Guedan, A. Gros, J. Martinez-Quintanilla, A. Hemminki, R. Alemany, A modified E2F-1 promoter improves the efficacy to toxicity ratio of oncolytic adenoviruses, Gene Ther, 16 (2009) 1441-1451.
- J. Martinez-Quintanilla, M. Cascallo, A. Gros, C. Fillat, R. Alemany, Positive selection of gene-modified cells increases the efficacy of pancreatic cancer suicide gene therapy, Mol Cancer Ther, 8 (2009) 3098-3107.
- M. Huch, A. Gros, A. Jose, J.R. Gonzalez, R. Alemany, C. Fillat, Urokinase-type plasminogen activator receptor transcriptionally controlled adenoviruses eradicate pancreatic tumors and liver metastasis in mouse models, Neoplasia, 11 (2009) 518-528, 514 p following 528.
- N. Bayo-Puxan, M. Gimenez-Alejandre, S. Lavilla-Alonso, A. Gros, M. Cascallo, A. Hemminki, R. Alemany, Replacement of adenovirus type 5 fiber shaft heparan sulfate proteoglycan-binding domain with RGD for improved tumor infectivity and targeting, Hum Gene Ther, 20 (2009) 1214-1221.
- S. Guedan, A. Gros, M. Cascallo, R. Vile, E. Mercade, R. Alemany, Syncytia formation affects the yield and cytotoxicity of an adenovirus expressing a fusogenic glycoprotein at a late stage of replication, Gene Ther, 15 (2008) 1240-1245.
- A. Gros, J. Martinez-Quintanilla, C. Puig, S. Guedan, D.G. Mollevi, R. Alemany, M. Cascallo, Bioselection of a gain of function mutation that enhances adenovirus 5 release and improves its antitumoral potency, Cancer Res, 68 (2008) 8928-8937.
- M. Cascallo, A. Gros, N. Bayo, T. Serrano, G. Capella, R. Alemany, Deletion of VAI and VAII RNA genes in the design of oncolytic adenoviruses, Hum Gene Ther, 17 (2006) 929-940.
- N. Bayo-Puxan, M. Cascallo, A. Gros, M. Huch, C. Fillat, R. Alemany, Role of the putative heparan sulfate glycosaminoglycan-binding site of the adenovirus type 5 fiber shaft on liver detargeting and knob-mediated retargeting, J Gen Virol, 87 (2006) 2487-2495.
- Grantor: Miguel Servet (Type 2). Title: Characterization of neoantigen-specific T cells and identification of predictive biomarkers of response in patients with MSI and MSI-like CRC treated with anti-PDL1.
- Grantor: Instituto de Salud Carlos III (ISCIII). Title: Terapia celular de próxima generación con TIL específicos de neoantígenos para pacientes con tumores resistentes a inhibidores de puntos de control inmunitario.
- Grantor: Fundación Fero (Beca Fero). Title: Non-invasive personalized T-cell therapies targeting recurrent hot spot driver mutations in cancer.
- Grantor: Fundación BBVA. Alena Gros is a member of the BBVA Foundation’s Immunotherapy & Immunology Program (CAIMI) at VHIO.
- Grantor: La Marató de TV3. Title: Personalized Immunotherapy for Endometrial Cancer.
- Grantor: La Caixa Health Research. Title: Development of enabling technologies for T-cell immunotherapy of solid tumors.
- Grantor: Ministerio de Ciencia e Innovación. Title: Mining the molecular determinants of the personalized T-cell response in cancer patients to develop more effective immunotherapies.


















