
Nuestro grupo se centra en la interacción entre las respuestas al estrés, la plasticidad celular y el cáncer. La plasticidad celular se reconoce hoy en día como una característica crítica de las células cancerosas que les permite transitar entre diferentes estados celulares y favorecer el crecimiento tumoral, la progresión de la enfermedad después de la terapia y la metástasis.
Con anterioridad, hemos constatado que inducir la desdiferenciación con los llamados factores de Yamanaka puede dar lugar al desarrollo de distintos tumores. También hemos demostrado que el daño tisular, principal impulsor del cáncer, desencadena el inicio de la senescencia celular, que luego induce la desdiferenciación y la adquisición de propiedades de las células madre in vivo.
Estas observaciones tienen importantes implicaciones terapéuticas, dado que la quimioterapia y la radioterapia, piedras angulares para el tratamiento de la mayoría de los tipos de cáncer, podrían tener el efecto secundario de inducir la formación de células madre en las células cancerosas no madre y, a su vez, contribuir a la recurrencia del tumor y la diseminación de las células cancerosas.
Nuestro principal objetivo es avanzar en el conocimiento de los mecanismos e impulsores implicados en este proceso, con la finalidad de desarrollar nuevos tratamientos a partir de la inhibición de la plasticidad de las células cancerosas.
Distintos hallazgos recientes han demostrado que algunas regiones genómicas, antes consideradas no codificantes (incluidos los lncRNA), contienen pequeños marcos de lectura abiertos que codifican microproteínas no anotadas y conservadas evolutivamente. Las pocas que se han identificado hasta la fecha asumen funciones clave en procesos celulares elementales, lo que da lugar a un nuevo nivel de complejidad con importantes implicaciones, desde la investigación básica hasta el ámbito clínico.
En los últimos años, nuestros esfuerzos se han centrado en descubrir y describir nuevas microproteínas cancerígenas que podrían ser nuevos actores en la carcinogénesis. Nuestro grupo ha identificado cinco nuevas microproteínas del cáncer y hemos obtenido pruebas convincentes in vitro e in vivo de que cuatro de ellas actúan como nuevos supresores tumorales, induciendo la detención del ciclo celular, la diferenciación o la inhibición de los rasgos mesenquimales de las células cancerosas. Además, con el uso de un enfoque peptidómico, hemos identificado un conjunto de microproteínas segregadas por tumores pancreáticos, ya sean solubles o en exosomas. Estas nuevas microproteínas podrían ser mensajeros celulares cruciales para la metástasis del cáncer de páncreas. La identificación de microproteínas tumorales podría ser clave para avanzar en el conocimiento de la fisiopatología del cáncer. Además, también podrían servir como nuevos biomarcadores del cáncer para la detección precoz de la enfermedad y la estratificación de pacientes para tratamientos a medida, así como para las dianas terapéuticas.
- Avanzar en el conocimiento de la interacción entre la senescencia inducida por la terapia, la plasticidad celular y el cáncer.
- Descifrar los mecanismos moleculares que rigen la adquisición de propiedades de las células madre durante la oncogénesis y después de la terapia.
- Descubrir y caracterizar nuevas microproteínas implicadas en la plasticidad de las células cancerosas.
- Desarrollar nuevas terapias antineoplásicas basadas en la inhibición de la plasticidad de las células cancerosas.
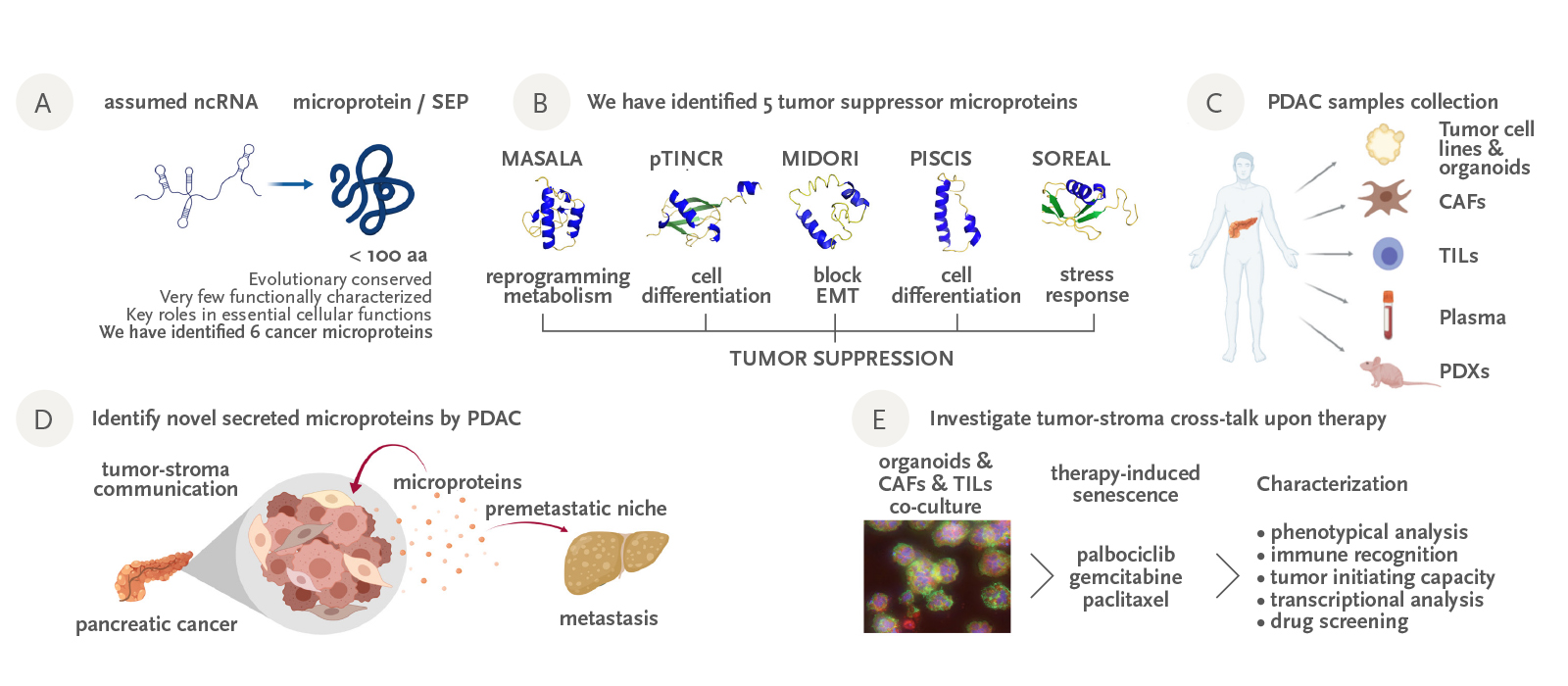
Figura: A) Hallazgos recientes han revelado que muchas regiones genómicas antes consideradas como no codificantes en realidad codifican microproteínas no anotadas; algunas de ellas han demostrado ser importantes para el cáncer. B) Nuestro grupo ha identificado cinco nuevas microproteínas con actividades supresoras de tumores. Las hemos caracterizado in vitro e in vivo. C) Hemos generado una amplia colección de muestras de cáncer de páncreas con pacientes asociados y que va a ser fundamental para nuestra investigación. D) Estamos investigando si las células cancerosas utilizan microproteínas secretadas no anotadas como mensajeros intercelulares para favorecer el crecimiento tumoral y la metástasis. E) Estamos estableciendo cocultivos de organoides-CAF-LIT para investigar el impacto de la terapia en la interacción entre tumor y estroma.
Jefa de grupo
María Abad
Asistente de investigación
Lluis Palenzuela
Estudiantes de postgrado
Alba Escriche
Marion Martinez
- Marin I, Boix O, Garcia-Garijo A, Sirois I, Caballe A, Zarzuela E, Ruano I, Attolini CS, Prats N, López-Domínguez JA, Kovatcheva M, Garralda E, Muñoz J, Caron E, Abad M, Gros A, Pietrocola F, Serrano M. Cellular Senescence Is Immunogenic and Promotes Antitumor Immunity. Cancer Discov. 2023 Feb 6;13(2):410-431.
- Pujals M, Mayans C, Bellio C, Méndez O, Greco E, Fasani R, Alemany-Chavarria M, Zamora E, Padilla L, Mitjans F, Nuciforo P, Canals F, Nonell L, Abad M, Saura C, Tabernero J, Villanueva J. RAGE/SNAIL1 signaling drives epithelial-mesenchymal plasticity in metastatic triple-negative breast cancer. Oncogene. 2023 Aug;42(35):2610-2628.
- Álvarez-Sierra D, Sánchez-Gaona N, Cruz Cobo M, Escriche A, Abad M, Gómez-Brey A, Bello I, Caubet E, González Ó, Zafón C, Iglesias C, Moreno P, Petit A, Fernández-Sanmartín MA, Martínez-Gallo M, Pujol-Borrell R. Thyroid cells from normal and autoimmune thyroid glands suppress T lymphocytes proliferation upon contact revealing a new regulatory inhibitory type of interaction independent of PD1/PDL1. J Autoimmun. 2023 Apr;136:103013.
- Boix O, Martinez M, Vidal S, Giménez-Alejandre M, Palenzuela L, Lorenzo-Sanz L, Quevedo L, Moscoso O, Ruiz-Orera J, Ximénez-Embún P, Ciriaco N, Nuciforo P, Stephan-Otto Attolini C, Albà MM, Muñoz J, Tian TV, Varela I, Vivancos A, Ramón Y Cajal S, Muñoz P, Rivas C, Abad M. pTINCR microprotein promotes epithelial differentiation and suppresses tumor growth through CDC42 SUMOylation and activation. Nat Commun. 2022 Nov 11;13(1):6840.
- Marin I, Boix O, Garcia-Garijo A, Sirois I, Caballe A, Zarzuela E, Ruano I, Stephan-Otto Attolini C, Prats N, Lopez-Dominguez JA, Kovatcheva M, Garralda E, Munoz J, Caron E, Abad M, Gros A, Pietrocola F, Serrano M. Cellular senescence is immunogenic and promotes anti-tumor immunity. Cancer Discov. Epub 2022 Oct 27.
- Senís E, Esgleas M, Najas S, Jiménez-Sábado V, Bertani C, Giménez-Alejandre M, Escriche A, Ruiz-Orera J, Hergueta-Redondo M, Jiménez M, Giralt A, Nuciforo P, Albà MM, Peinado H, Del Toro D, Hove-Madsen L, Götz M, Abad M. TUNAR lncRNA Encodes a Microprotein that Regulates Neural Differentiation and Neurite Formation by Modulating Calcium Dynamics. Front Cell Dev Biol. 2021 Dec 31;9:747667.
- Senís E, Mosteiro L, Grimm D, Abad M. A Versatile In Vivo System to Study Myc in Cell Reprogramming. Methods Mol Biol. 2021;2318:267-279.
- Senís E, Mosteiro L, Grimm D, Abad M. Methods Mol Biol. 2021;2318:267-279. doi: 10.1007/978-1-0716-1476-1_14.
- Salazar-Roa M, Trakala M, Alvarez-Fernandez M, Valdes-Mora F, Munoz J, Zapatero-Solana E, Grana O, Peters T,Abad M, Bueno M, Gomez de Cedron M, Fernandez-Piqueras J, De Martino A, Serrano M, Wang D, Clark S, Ortega S and Malumbres M. Transient exposure to miR-203 enhances the differentiation capacity of established pluripotent stem cells. In press. Embo Journal. DOI:10.15252/embj.2019104324
- Merino I, Greco E,Abad M(2020). The microproteome of cancer: from invisibility to relevance.Experimental Cell Research. 2020;392(1):111997. doi:10.1016/j.yexcr.2020.111997
- Senís E, Mosteiro L, Wilkening S, Wiedtke E, Nowrouzi A, Afzal S, Fronza R, Landerer H,Abad M, Niopek D, Schmidt M, Serrano M, Grimm D.AAVvector-mediated in vivo reprogramming into pluripotency.Nat Commun. 2018 Jul 9;9(1):2651. doi: 10.1038/s41467-018-05059-x.
- Abad M, Hashimoto H, Zhou H, Morales MG, Chen B, Bassel-Duby R, Olson EN.Notch Inhibition Enhances Cardiac Reprogramming by Increasing MEF2C Transcriptional Activity. Stem Cell Reports. 2017 Mar 14;8(3):548-560.
- Marión RM, López de Silanes I, Mosteiro L, Gamache B, Abad M, Guerra C, Megías D, Serrano M, Blasco MA.Common Telomere Changes during In Vivo Reprogramming and Early Stages of Tumorigenesis. Stem Cell Reports. 2017 Feb 14;8(2):460-475.
- Gómez-Cabello D, Checa-Rodríguez C, Abad M, Serrano M, Huertas P.CtIP-Specific Roles during Cell Reprogramming Have Long-Term Consequences in the Survival and Fitness of Induced Pluripotent Stem Cells. Stem Cell Reports. 2017 Feb 14;8(2):432-445.
- Mosteiro L, Pantoja C, Alcázar N, Marión RM, Chondronasiou D, Rovira M, Fernández-Marcos PJ, Muñoz M, Blanco-Aparicio C, Pastor J, Gómez-López G, de Martino A, Blasco MA, Abad M and Serrano M. Tissue damage and senescence provide critical signals for cellular reprogramming in vivo. Science. 2016 Nov 25;354(6315). pii: aaf4445.
- Adrados I., Larrasa J., Galarreta A., López-Antona I., Menendez C., Abad M., Gil J., Moreno-Bueno G. And Palmero I. The homeoprotein SIX1 controls cellular senescence through the regulation of p16INK4A and differentiation-related genes. Oncogene. 2016 Jul 7;35(27):3485-94
- Vilas JM, Ferreirós A, Carneiro C, Morey L, Da Silva-Álvarez S, Fernandes T, Abad M, Di Croce L, García-Caballero T, Serrano M, Rivas C, Vidal A, Collado M. Transcriptional regulation of Sox2 by the retinoblastoma family of pocket proteins. Oncotarget. 2015 Feb 20;6(5):2992-3002.
- Palla A.R., Piazzolla D., Abad M., Li H., Dominguez O., Schönthaler H.B., Wagner E.F. and Serrano M.Reprogramming activity of NANOGP8, a NANOG family member widely expressed in cancer. Oncogene.2014 May 8;33(19):2513-9
- Abad M, Mosteiro L, Pantoja C, Cañamero M, Rayon T, Ors I, Graña O, Megías D, Domínguez O, Martínez D, Manzanares M, Ortega S, Serrano M.Reprogramming in vivo produces teratomas and iPS cells with totipotency features. Nature. 2013 Oct 17;502(7471):340-5.
- Abad M, Moreno A, Palacios A, Narita M, Blanco F, Moreno-Bueno G, Narita M and Palmero I.The tumor suppressor ING1 contributes to epigenetic control of cellular senescence. Aging Cell. 2011 Feb; 10:158-71.
- Menéndez C, Abad M, Gómez-Cabello D, Moreno A and Palmero I. ING proteins in cellular senescence. Curr Drug Targets. 2009 May;10:406-1.
- Abad M, Menéndez C, Fuchtabuer A, Serrano M, Fuchtbauer E-M and Palmero I.Ing1 mediates p53 accumulation and chromatin modification in response to oncogenic stress.J Biol Chem. 2007 Oct 19;282:31060-7
- Goeman F.,Thormeyer D., Abad M., Serrano M., Schmidt O., Palmero I. and Baniahmad A. Growth inibition by the tumor suppressor p33ING1 in immortalized and primary cells: Involvement of two silencing domains and effect of Ras.Mol Cell Biol. 2005 Jan;25:422-31.
- Tumoral senescence induced by anti-cancer therapies constitutes a novel prognostic biomarker and a therapeutic target.
Reference: PRYCO211023SERR.
Spanish Association Against Cancer – AECC.
Award Period: 9/2021-8/2026
Co-PI: María Abad. - Defining the Role of Exosome-Secreted Micropeptides in Pancreatic Cancer. number: HR18-00256.
Health Research Grant-La Caixa Foundation.
Award Period: 9/2019-8/2021.
PI: Maria Abad. - Identificación y Análisis del Microproteoma del Cáncer de Páncreas: Los Micropéptidos como Nuevas Dianas Terapéuticas y Biomarcadores Tumorales Fundación. XVI Convocatoria de Ayudas a la Investigación en Salud.
Fundación Mutua Madrileña.
01/09/2019-30/08/2022.
PI: Maria Abad. - Mining the Microproteome for New Molecular Targets in Cancer.
number: RTI2018-102046-B-I00.Spanish Ministry of Economy and Competitiveness.
1/2019-12/2021.
PI: Maria Abad.
















