
Un estudi liderat per l’Institut Hospital del Mar d’Investigacions Mèdiques demostra que l’oxaliplatí que s’administra en alguns casos de càncer de còlon i recte s’acumula a les cèl·lules sanes de l’entorn del tumor.
Aquest fet provoca que aquestes cèl·lules sanes generin una proteïna que les activa, podent així provocar resistència de les cèl·lules tumorals al tractament i ajudant al fet que es torni a generar el tumor. A la vegada, s’ha descobert un marcador que permet identificar els tumors que tenen expressada aquesta proteïna i, per tant, no responen a la quimioteràpia.
L’estudi, que publica la revista Nature Communications, obre la porta a nous tractaments que permetin potenciar els efectes de la quimioteràpia sobre les cèl·lules tumorals, evitant-ne els efectes secundaris sobre les cèl·lules sanes del tumor i, d’aquesta forma, evitar la progressió tumoral.
Un dels tipus de quimioteràpia que serveix per tractar el càncer de còlon i recte avançat, la quimioteràpia basada en el platí, s’acumula a les cèl·lules sanes que rodegen les cèl·lules canceroses, i, com a conseqüència, pot fer disminuir la sensibilitat del càncer al tractament. Així ho demostra un estudi de l’Institut Hospital del Mar d’Investigacions Mèdiques (IMIM-Hospital del Mar), amb participació de l’Instituto de Investigación Sanitaria INCLIVA, l’Institut Català d’Oncologia (ICO), el Vall d’Hebron Institut d’Oncologia (VHIO), l’Institut de Recerca Biomèdica (IRB) de Barcelona, la Universidad de Oviedo i el CIBER del càncer (CIBERONC), que publica la revista Nature Communications.
Un nombre elevat de pacients en tractament per càncer reben tractaments basats en el platí. Però un bon nombre de tumors tenen la capacitat de generar resistència a aquest abordatge. Per esbrinar els motius, aquest treball ha analitzat mostres de pacients amb càncer de còlon i recte avançat i han validat els resultats en models de ratolí. Així han pogut veure com en aquests tractaments, el platí s’acumula de forma molt destacada a les cèl·lules sanes que envolten el tumor, en especial en els fibroblasts, les cèl·lules que contribueixen a la creació de teixits. A més, aquesta acumulació es manté durant llargs períodes de temps, més de dos anys després de la finalització del tractament. Per a fer-ho, s’han utilitzat tècniques desenvolupades en el camp de la geologia aplicades a les mostres biològiques.
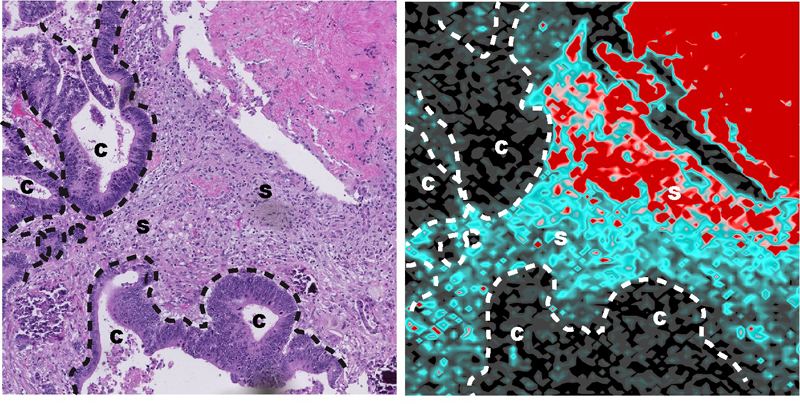
Acumulació d’oxaliplatí al microambient tumoral d’un pacient amb càncer de còlon 44 dies després del tractament.
L’efecte del platí sobre els fibroblasts
Els investigadors van poder comprovar com aquesta acumulació de platí en els fibroblasts, generava l’activació de determinats gens, vinculats a una mala resposta al tractament amb quimioteràpia i a la progressió tumoral, entre ells, els relacionats amb la proteïna TGF-β, que estimula als mateixos fibroblasts i provoca que ajudin a les cèl·lules tumorals que han sobreviscut a la quimioteràpia a progressar de nou. Això porta al Dr. Alexandre Calon, responsable del Laboratori de Recerca traslacional en microambient tumoral de l’IMIM-Hospital del Mar, i que lidera l’estudi, a apuntar que “l’activació dels fibroblasts, per l’oxaliplatí pot generar mecanismes de resistència a la mateixa quimioteràpia”.
Actualment, no es disposa de marcadors predictius de resposta a la quimioteràpia en càncer de còlon i recte. En aquest sentit, aquest treball ha permès comprovar amb mostres d’una trentena de pacients, d’abans i de després de sotmetre’s a quimioteràpia, que els nivells d’una altra proteïna, la periostina, són un indicador d’activitat de TGF-β als fibroblasts, i funcionen com un bon marcador de resposta a la quimioteràpia. Així, aquesta resposta era dolenta en aquelles persones a les quals els nivells de periostina eren elevats abans de rebre les primeres dosis o en aquells que eren baixos, però es disparaven després del tractament. Així mateix, en models de ratolí es va certificar que en aquells on es provocaven nivells més alts d’aquesta proteïna, el tractament contra el tumor perd efectivitat.
Per tot plegat, la Dra. Jenniffer Linares, primera autora de l’estudi, afirma que “hem descobert un mecanisme de resistència a l’oxaliplatí i un marcador d’aquesta resistència en pacients amb càncer de còlon i recte”. Un fet que demostra, segons el Dr. Calon, que cal tenir en compte l’entorn del tumor a l’hora de desenvolupar els tractaments contra el càncer. “Les quimioteràpies s’avaluen en relació amb la seva efectivitat sobre les cèl·lules canceroses, no sobre les cèl·lules sanes que formen el microambient tumoral, que protegeix el tumor”, apunta.
Buscar una forma de superar-ho
Els investigadors treballen ara per desenvolupar un nou tipus d’abordatge que permeti restaurar la capacitat de la quimioteràpia sobre les cèl·lules tumorals. Ho han fet en un nou estudi pendent de publicació, i es basa en la combinació de la medicació amb un pèptid que evita que el platí s’acumuli als fibroblasts.
En aquest sentit, el Dr. Andrés Cervantes, director científic de l’Institut de Recerca Biomèdica INCLIVA i investigador del CIBER del Càncer (CIBERONC), apunta que “l’estudi reforça el protagonisme que les cèl·lules no tumorals poden tenir a la resposta a la quimioteràpia i que aquestes troballes obren la porta a una estratègia d’oncologia de precisió que permeti reconèixer la diversitat dels mecanismes de sensibilitat i resistència als tractaments, actuant de manera diferent segons els mateixos i facilitant una acció més personalitzada”.
Tal com diu la Dra. Clara Montagut, cap de secció de tumors gastrointestinals de l’Hospital del Mar i investigadora del CIBERONC, “aquest estudi és un pas important per entendre perquè el tractament de quimioteràpia no funciona igual en tots els pacients amb càncer, i poder prevenir o revertir la resistència a la quimioteràpia. És un pas rellevant també per comprendre que el tractament del càncer ha de tenir en compte no només les cèl·lules canceroses, sinó també les cèl·lules sanes que envolten el tumor, l’anomenat microambient. El següent pas crític serà desenvolupar estratègies farmacològiques que actuïn sobre la cèl·lula cancerosa i modulin el microambient a favor de l’eliminació del tumor”.
El treball ha comptat amb el suport del Instituto de Salud Carlos III i de l’Associació Contra el Càncer (TuMICC project, Junior Clinician fellowship).
La participació del VHIO en aquest estudi ha estat a través del projecte TUMICC dirigit a demostrar el valor del microambient tumoral en la predicció de recaigudes en pacients amb càncer de còlon localitzat tractats amb tractament adjuvant. Els grups de VHIO que en formen part són el Grup de Cèl·lules Mare i Càncer liderat pel Dr. Hector García Palmer, el Grup d’Investigació en Càncer colorectal liderat per la Dra. Elena Élez i el Grup d’Oncologia Molecular, liderat pel Dr. Paolo Nuciforo. En aquest estudi que ara publica Nature Medicine, VHIO ha participat en la inclusió de pacients a l’estudi així com en la recollida de mostres i imatges del tumors tant prospectiva com retrospectivament. El VHIO ha liderat la generació dels models preclínics de pacients, més específicament els models xenografts derivats de pacients.
Article de referència
Linares, J., Sallent-Aragay, A., Badia-Ramentol, J. et al. Long-term platinum-based drug accumulation in cancer-associated fibroblasts promotes colorectal cancer progression and resistance to therapy. Nat Commun 14, 746 (2023). https://doi.org/10.1038/s41467-023-36334-1

























